A distribuição eletrônica dos átomos de
nitrogênio presentes no NPK, quando estão no
estado fundamental é:









A concentração de CO2 na atmosfera vem aumentando nos últimos anos. Segundo os cientistas, o aumento da quantidade desse gás que é dissolvida no oceano pode prejudicar particularmente os corais e as espécies que têm conchas duras.
O equilíbrio do CO2 em solução aquosa pode ser representado pelas seguintes etapas:
CO2 (g) ⇌ CO2 (aq) (1)
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq) (2)
H2CO3 (aq) ⇌ HCO3 - (aq) + H+ (aq) (3)
A dissolução do CO2 no oceano provoca
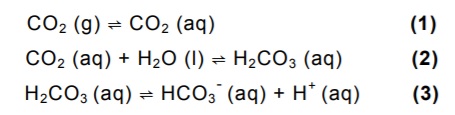
As etapas (1) e (3), mostradas na questão anterior, representam, respectivamente, processos de:

Os ácidos cítrico (Estrutura 1) e ascórbico (Estrutura 2), encontrados no limão, são nutrientes que podem proporcionar benefícios importantes ao organismo, como a estimulação do sistema imunológico.

Em relação a essas duas substâncias, é correto afirmar: