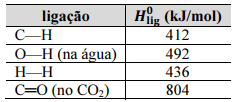
Considerando as informações da situação hipotética apresentada, julgue o item seguinte.
A chance de se escolher ao acaso o prontuário de uma pessoa
com idade até 15 anos com problemas respiratórios ou de
uma pessoa com mais de 50 anos de idade é inferior a 50%.
Considerando as informações da situação hipotética apresentada, julgue o item seguinte.
A chance de se escolher ao acaso o prontuário de uma pessoa com idade até 15 anos com problemas respiratórios ou de uma pessoa com mais de 50 anos de idade é inferior a 50%.
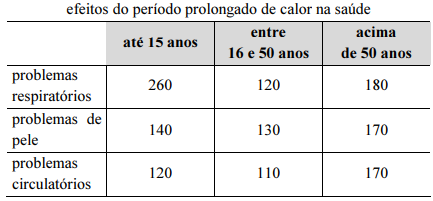
Com o objetivo de conhecer o efeito de um período prolongado de dias quentes sobre a saúde dos indivíduos, foi realizada uma pesquisa com 1.400 moradores de várias cidades, cujos resultados, agrupados de acordo com as faixas etárias desses indivíduos, conforme descrição em 1.400 prontuários médicos, constam na tabela precedente.