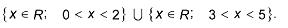d58a7033-62
UFMG 2007 - Química - Transformações Químicas e Energia, Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Numa aula no Laboratório de Química, os alunos prepararam, sob supervisão do professor, duas soluções aquosas, uma de cloreto de potássio, KCl, e uma de cloreto de cálcio,  .
.
Após observarem a variação da temperatura em função do tempo, durante o preparo de cada uma dessas soluções, os alunos elaboraram este gráfco:

Considerando-se as informações fornecidas por esse gráfco e outros conhecimentos sobre o assunto, é CORRETO afrmar que
Numa aula no Laboratório de Química, os alunos prepararam, sob supervisão do professor, duas soluções aquosas, uma de cloreto de potássio, KCl, e uma de cloreto de cálcio,  .
.
Após observarem a variação da temperatura em função do tempo, durante o preparo de cada uma dessas soluções, os alunos elaboraram este gráfco:

Considerando-se as informações fornecidas por esse gráfco e outros conhecimentos sobre o assunto, é CORRETO afrmar que
 .
. Após observarem a variação da temperatura em função do tempo, durante o preparo de cada uma dessas soluções, os alunos elaboraram este gráfco:

Considerando-se as informações fornecidas por esse gráfco e outros conhecimentos sobre o assunto, é CORRETO afrmar que
A
a dissolução do  diminui a energia cinética média das moléculas de água.
diminui a energia cinética média das moléculas de água.
 diminui a energia cinética média das moléculas de água.
diminui a energia cinética média das moléculas de água.B
a dissolução do KCl é um processo exotérmico.
C
a entalpia de dissolução do  é maior que zero.
é maior que zero.
 é maior que zero.
é maior que zero.D
a solubilidade do KCl aumenta com o aumento da temperatura.
 e ácido sulfúrico,
e ácido sulfúrico,  . No interior do extintor, essas duas substâncias fcam separadas, uma da outra. Para ser usado, o extintor deve ser virado de cabeça para baixo, a fm de possibilitar a mistura dos compostos, que, então, reagem entre si.
. No interior do extintor, essas duas substâncias fcam separadas, uma da outra. Para ser usado, o extintor deve ser virado de cabeça para baixo, a fm de possibilitar a mistura dos compostos, que, então, reagem entre si. 




 são azuis e que as de nitrato de zinco (II),
são azuis e que as de nitrato de zinco (II),  são incolores.
são incolores. 
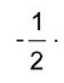
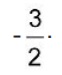

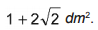
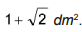
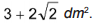
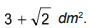
 em que
em que  é a concentração de íons, dada em mol por litro.
é a concentração de íons, dada em mol por litro.
 , dióxido de carbono,
, dióxido de carbono, 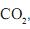 , e hélio, He, são gases.
, e hélio, He, são gases.
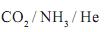


 na concentração de 1 mol/L, foi armazenado durante um ano.
na concentração de 1 mol/L, foi armazenado durante um ano.
 (g) foram adicionados a um recipiente, que, imediatamente, foi fechado e mantido em temperatura constante.
(g) foram adicionados a um recipiente, que, imediatamente, foi fechado e mantido em temperatura constante.  (g) se decompôs, transformando-se em
(g) se decompôs, transformando-se em  (g) e
(g) e 
 em mol, variou com o tempo, até o sistema alcançar o equilíbrio, como mostrado neste quadro:
em mol, variou com o tempo, até o sistema alcançar o equilíbrio, como mostrado neste quadro:
 a pressão do sistema é maior que em
a pressão do sistema é maior que em  .
.