057df5b9-da
UniCEUB 2019 - Química - Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais., Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica., Soluções e Substâncias Inorgânicas
Considere as seguintes soluções aquosas e suas respectivas
concentrações em mol/L:
• Na2
SO4 0,10 mol/L
• C6
H12O6 0,30 mol/L
• KCl 0,15 mol/L
Comparando essas três soluções, pode-se afirmar que elas
têm a mesma
Considere as seguintes soluções aquosas e suas respectivas
concentrações em mol/L:
• Na2
SO4 0,10 mol/L
• C6
H12O6 0,30 mol/L
• KCl 0,15 mol/L
Comparando essas três soluções, pode-se afirmar que elas
têm a mesma
A
condutibilidade elétrica.
B
concentração em gramas de soluto por litro.
C
quantidade de moléculas de soluto por litro.
D
pressão osmótica.
E
densidade.







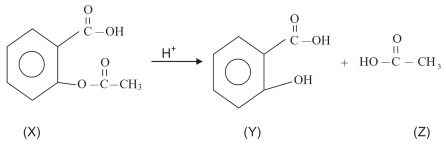
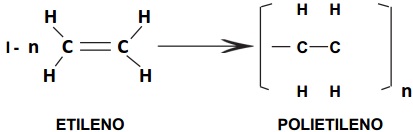
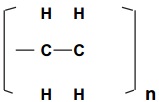
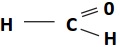 → BAQUELITE (FÓRMICA)
→ BAQUELITE (FÓRMICA)