d5bd393d-49
UFRN 2010, UFRN 2010, UFRN 2010 - Química - Transformações Químicas: elementos químicos, tabela periódica e reações químicas, Transformações Químicas
Segundo as teorias atuais da evolução, a vida não poderia ter se desenvolvido no planeta Terra sem a proteção fornecida pela camada de ozônio. Este se forma naturalmente a partir do oxigênio molecular. Tal transformação ocorre na estratosfera. A presença de fótons (com energia suficiente) provoca uma ruptura homolítica nas moléculas de oxigênio. Os átomos de oxigênio colidem com moléculas de oxigênio para formar ozônio. Uma quantidade de ozônio formado pode reagir com átomos de oxigênio e formar oxigênio molecular. Assim, o ozônio é formado e transformado continuamente de forma natural, num processo que atinge um equilíbrio dinâmico, o qual possibilita a existência de ozônio na estratosfera.
Os processos químicos descritos no texto são corretamente representados em:
Segundo as teorias atuais da evolução, a vida não poderia ter se desenvolvido no planeta Terra sem a proteção fornecida pela camada de ozônio. Este se forma naturalmente a partir do oxigênio molecular. Tal transformação ocorre na estratosfera. A presença de fótons (com energia suficiente) provoca uma ruptura homolítica nas moléculas de oxigênio. Os átomos de oxigênio colidem com moléculas de oxigênio para formar ozônio. Uma quantidade de ozônio formado pode reagir com átomos de oxigênio e formar oxigênio molecular. Assim, o ozônio é formado e transformado continuamente de forma natural, num processo que atinge um equilíbrio dinâmico, o qual possibilita a existência de ozônio na estratosfera.
Os processos químicos descritos no texto são corretamente representados em:
Os processos químicos descritos no texto são corretamente representados em:
A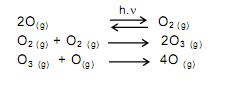

B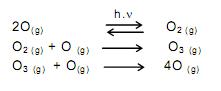

C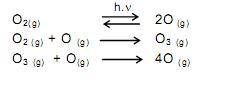
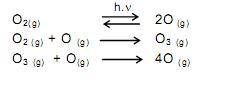
D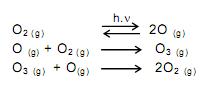

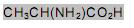


 o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
o volume de nitrogênio gasoso que se obtém é, aproximadamente, de 

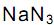 , o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de 
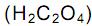 , como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
, como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino. 
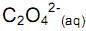 deslocando o equilíbrio para os produtos.
deslocando o equilíbrio para os produtos.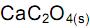 , deslocando o equilíbrio para os reagentes.
, deslocando o equilíbrio para os reagentes.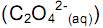 desloca o equilíbrio, aumentando a quantidade de
desloca o equilíbrio, aumentando a quantidade de 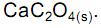
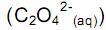 desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq).
desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq). ), em meio sulfúrico, um aluno elaborou o seguinte esquema:
), em meio sulfúrico, um aluno elaborou o seguinte esquema:



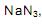 o volume de nitrogênio gasoso que se obtém é, aproximadamente,
o volume de nitrogênio gasoso que se obtém é, aproximadamente, em meio sulfúrico, um aluno elaborou o seguinte esquema:
em meio sulfúrico, um aluno elaborou o seguinte esquema:
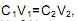 o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução di luída corresponderá a:
o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução di luída corresponderá a:  como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
 deslocando o equilíbrio para os produtos.
deslocando o equilíbrio para os produtos. deslocando o equilíbrio para os reagentes.
deslocando o equilíbrio para os reagentes. desloca o equilíbrio, aumentando a quantidade de
desloca o equilíbrio, aumentando a quantidade de 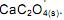
 desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)
desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)