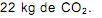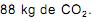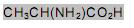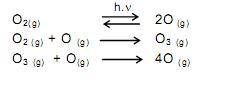d9edf651-49
UFRN 2010, UFRN 2010, UFRN 2010 - Química - Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente
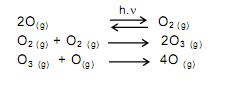
A quantidade de nitrogênio na água, sob suas diversas formas compostas (orgânico, amoniacal, nitritos e nitratos), pode indicar uma poluição recente ou remota (menor ou maior tempo de contaminação). O nitrogênio segue um ciclo desde a formação de compostos orgânicos, até a formação de compostos com estados de oxidação 3-, 3+ e 5+ (estado de oxidação máximo).
Sendo assim, é possível avaliar -se o grau de poluição pela concentração e pelo número de oxidação do nitrogênio no composto presente na água, quando não existem outros efeitos de contaminação que não seja nitrogênio de origem orgânica.
Desejando-se tratar as águas contaminadas de quatro rios, com prioridade para o rio cujas águas apresentavam maior tempo de contaminação, foram realizados testes em amostras de água dos quatro rios, cujos resultados se mostram no Quadro abaixo:

De acordo com o texto e as informações do Quadro, pode-se afirmar que o rio a ter primeiramente suas águas tratadas, por apresentar o maior tempo de contaminação, é o identificado como
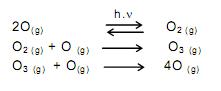
A quantidade de nitrogênio na água, sob suas diversas formas compostas (orgânico, amoniacal, nitritos e nitratos), pode indicar uma poluição recente ou remota (menor ou maior tempo de contaminação). O nitrogênio segue um ciclo desde a formação de compostos orgânicos, até a formação de compostos com estados de oxidação 3-, 3+ e 5+ (estado de oxidação máximo).
Sendo assim, é possível avaliar -se o grau de poluição pela concentração e pelo número de oxidação do nitrogênio no composto presente na água, quando não existem outros efeitos de contaminação que não seja nitrogênio de origem orgânica.
Desejando-se tratar as águas contaminadas de quatro rios, com prioridade para o rio cujas águas apresentavam maior tempo de contaminação, foram realizados testes em amostras de água dos quatro rios, cujos resultados se mostram no Quadro abaixo:

De acordo com o texto e as informações do Quadro, pode-se afirmar que o rio a ter primeiramente suas águas tratadas, por apresentar o maior tempo de contaminação, é o identificado como
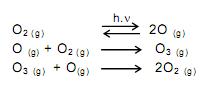
Sendo assim, é possível avaliar -se o grau de poluição pela concentração e pelo número de oxidação do nitrogênio no composto presente na água, quando não existem outros efeitos de contaminação que não seja nitrogênio de origem orgânica.
Desejando-se tratar as águas contaminadas de quatro rios, com prioridade para o rio cujas águas apresentavam maior tempo de contaminação, foram realizados testes em amostras de água dos quatro rios, cujos resultados se mostram no Quadro abaixo:

De acordo com o texto e as informações do Quadro, pode-se afirmar que o rio a ter primeiramente suas águas tratadas, por apresentar o maior tempo de contaminação, é o identificado como
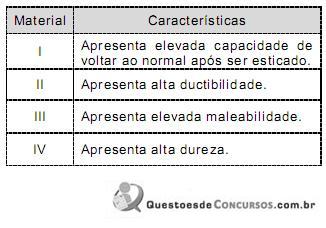
A
II.
B
III.
C
I.
D
IV.