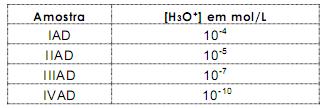
115b1f2d-f5
UFRN 2012 - Química - Glicídios, Lipídios, Aminoácidos e Proteínas., Química Orgânica
Diariamente gastamos energia em tudo o
que fazemos – correndo, nadando,
dançando, caminhando, pensando e até
dormindo. Sobre o processo de obtenção da
energia que utilizamos para essas e outras
atividades, é correto afirmar:
Diariamente gastamos energia em tudo o
que fazemos – correndo, nadando,
dançando, caminhando, pensando e até
dormindo. Sobre o processo de obtenção da
energia que utilizamos para essas e outras
atividades, é correto afirmar:
A
O dióxido de carbono e a água se
originam durante a glicólise, etapa que
ocorre no citoplasma da célula.
B
Na respiração celular, o oxigênio e a
glicose são utilizados para a produção de
ADP pelas células do corpo.
C
A glicose utilizada na respiração celular
provém da digestão dos carboidratos pelo
sistema digestório.
D
Nesse processo metabólico, o gás
carbônico é gerado em menor quantidade
quando a produção de energia é elevada.






 , é um fármaco com ação estimulante sobre o sistema nervoso central. Esse fármaco pode ser representado por dois compostos que apresentam a mesma fórmula estrutural, mas só um deles tem efeito fisiológico. A obtenção de medicamentos que tenham esse comportamento constitui um desafio para os químicos. O Prêmio Nobel de Química, em 2001, foi outorgado aos químicos William S. Knowles (EUA), K. Barry Sharpless (EUA) e Ryoj i Noyori (Japão) por desenvolverem métodos de sínteses com catalisadores assimétricos que permitem obter o enantiômero que interessa. O comportamento da anfetamina e os trabalhos dos químicos laureados com o Nobel dizem respeito
, é um fármaco com ação estimulante sobre o sistema nervoso central. Esse fármaco pode ser representado por dois compostos que apresentam a mesma fórmula estrutural, mas só um deles tem efeito fisiológico. A obtenção de medicamentos que tenham esse comportamento constitui um desafio para os químicos. O Prêmio Nobel de Química, em 2001, foi outorgado aos químicos William S. Knowles (EUA), K. Barry Sharpless (EUA) e Ryoj i Noyori (Japão) por desenvolverem métodos de sínteses com catalisadores assimétricos que permitem obter o enantiômero que interessa. O comportamento da anfetamina e os trabalhos dos químicos laureados com o Nobel dizem respeito 
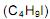 com a água a 25 o C pode ser estudada do ponto de vista da cinética química. A equação da reação é mostrada a seguir:
com a água a 25 o C pode ser estudada do ponto de vista da cinética química. A equação da reação é mostrada a seguir: