a94a5aef-03
UERJ 2023 - Química - Substâncias e suas propriedades
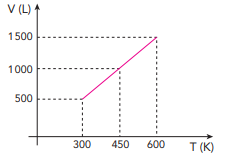
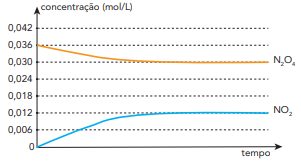
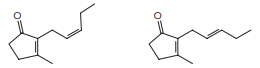
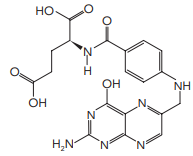
Para a produção de uma solução antisséptica à base de iodo, foram empregados 0,02 mol de I2,
0,06 mol de KI e determinada quantidade de água.
A massa total de iodo, em gramas, presente nessa solução é igual a:
Para a produção de uma solução antisséptica à base de iodo, foram empregados 0,02 mol de I2,
0,06 mol de KI e determinada quantidade de água.
A massa total de iodo, em gramas, presente nessa solução é igual a:
A
5,08
B
7,62
C
12,70
D
15,00