Questõesde UEG sobre Química
A fluorexetina é um fármaco largamente utilizado para distúrbios de ansiedade e depressão. O processo de
cristalização desse fármaco impacta diretamente na biodisponibilidade no organismo humano. No processo de
cristalização do oxalato de fluorexetina, estima-se uma variação da energia livre de Gibbs e da entalpia, a 25°C
de aproximadamente -180 kJ.mol-1
e -259 kJ.mol-1
, respectivamente. Com base nesses parâmetros
termodinâmicos, verifica-se que esse processo de cristalização é, a 25º C,
Supondo-se que um circuito elétrico composto por uma lâmpada incandescente seja conectado a um líquido
contido em um recipiente, qual dos compostos líquidos seria capaz de fazer a lâmpada acender?
Uma pilha de Daniel é um dispositivo capaz de transformar energia química em energia elétrica, e como exemplo
tem-se uma formada por eletrodos de ferro (Fe3+ +3e-  Fe(s) E0redução = -0,036 V) e estanho (Sn2+ +2e-
Fe(s) E0redução = -0,036 V) e estanho (Sn2+ +2e-  Sn(s) E0redução = -0,136 V). Nesse caso, constata-se que
Sn(s) E0redução = -0,136 V). Nesse caso, constata-se que
Uma pilha de Daniel é um dispositivo capaz de transformar energia química em energia elétrica, e como exemplo
tem-se uma formada por eletrodos de ferro (Fe3+ +3e-  Fe(s) E0redução = -0,036 V) e estanho (Sn2+ +2e-
Fe(s) E0redução = -0,036 V) e estanho (Sn2+ +2e-  Sn(s) E0redução = -0,136 V). Nesse caso, constata-se que
Sn(s) E0redução = -0,136 V). Nesse caso, constata-se que
O composto conhecido como glicol possui uma composição centesimal de 39% de carbono, 51% de oxigênio e
10% de hidrogênio. Dentre as opções a seguir, identifique aquela que pode ser considerada a fórmula mínima do
glicol.Dados: MM(H) = 1 g.mol-1, MM(C) = 12 g.mol-1
e MM(O) = 16 g.mol-1
O composto conhecido como glicol possui uma composição centesimal de 39% de carbono, 51% de oxigênio e
10% de hidrogênio. Dentre as opções a seguir, identifique aquela que pode ser considerada a fórmula mínima do
glicol.
Dados: MM(H) = 1 g.mol-1
, MM(C) = 12 g.mol-1
e MM(O) = 16 g.mol-1
Supondo-se que um circuito elétrico composto por uma lâmpada incandescente seja conectado a um líquido
contido em um recipiente, qual dos compostos líquidos seria capaz de fazer a lâmpada acender?
Líquidos de arrefecimento são utilizados para melhorar o sistema de refrigeração dos motores dos carros.
Geralmente são soluções aquosas de etilenoglicol, um diol, de fórmula molecular C2H6O2 e massa molar 62,1
g/mol. O rótulo de uma determinada marca de líquido de arrefecimento indica que há 50% de etilenoglicol em
massa, o que corresponde a 530 g por litro de solução. A concentração dessa solução aquosa de etilenoglicol,
em mol/L, é aproximadamente:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável,
proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo
agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não
contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo,
a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o
avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos
com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do
C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável, proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo, a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos com etanol ou gasolina, puros ou misturados em qualquer proporção.
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
Isômeros são compostos com a mesma composição química, mas diferentes estruturas. Essas diferenças
provocam alterações significativas nas propriedades químicas e físicas desses compostos. As figuras a seguir
representam três isômeros do pentano (C5H12).

Sabendo-se que a temperatura de ebulição depende da intensidade das forças intermoleculares, a qual depende
da geometria molecular, a ordem crescente de temperatura de ebulição dos três isômeros do pentano
apresentados é, respectivamente:
Isômeros são compostos com a mesma composição química, mas diferentes estruturas. Essas diferenças provocam alterações significativas nas propriedades químicas e físicas desses compostos. As figuras a seguir representam três isômeros do pentano (C5H12).

Sabendo-se que a temperatura de ebulição depende da intensidade das forças intermoleculares, a qual depende da geometria molecular, a ordem crescente de temperatura de ebulição dos três isômeros do pentano apresentados é, respectivamente:
O biodiesel é um biocombustível, ou seja, é derivado de fontes renováveis, e pode substituir parcial ou totalmente
os combustíveis derivados do petróleo. Reações químicas entre lipídios e álcoois de cadeia curta produzem os
ésteres de ácidos graxos constituintes do biodiesel. Um dos componentes do biodiesel produzido usando óleo de
soja e metanol é o éster metílico do ácido linoleico, cuja fórmula molecular é C19H34O2. Na combustão de 300
mols de C19H34O2, a quantidade de CO2 formada será:
Uma pilha de Daniel é um dispositivo capaz de transformar energia química em energia elétrica, e como exemplo
tem-se uma formada por eletrodos de ferro 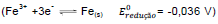 e estanho
e estanho 
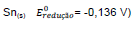 . Nesse caso, constata-se que
. Nesse caso, constata-se que
Uma pilha de Daniel é um dispositivo capaz de transformar energia química em energia elétrica, e como exemplo
tem-se uma formada por eletrodos de ferro 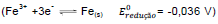 e estanho
e estanho 
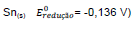 . Nesse caso, constata-se que
. Nesse caso, constata-se que
Questão 38
As chalconas são uma classe de moléculas que possuem vários tipos de atividades farmacológicas. No processo
de cristalização de um dos derivados de chalcona, mediu-se uma variação da energia livre de Gibbs e da
entalpia a 27 °C de -64 kcal.mol-1
e -164 kcal.mol-1
, respectivamente.
Nesse caso, a temperatura, em Kelvin, a partir da qual a cristalização sofrerá uma transição de um processo
espontâneo para não-espontâneo, será de aproximadamente
Questão 38 As chalconas são uma classe de moléculas que possuem vários tipos de atividades farmacológicas. No processo de cristalização de um dos derivados de chalcona, mediu-se uma variação da energia livre de Gibbs e da entalpia a 27 °C de -64 kcal.mol-1 e -164 kcal.mol-1 , respectivamente.
Nesse caso, a temperatura, em Kelvin, a partir da qual a cristalização sofrerá uma transição de um processo espontâneo para não-espontâneo, será de aproximadamente
O composto conhecido como glicol possui uma composição centesimal de 39% de carbono, 51% de oxigênio e
10% de hidrogênio. Dentre as opções a seguir, identifique aquela que pode ser considerada a fórmula mínima do
glicol.
Dados: MM(H) = 1 g.mol-1
, MM(C) = 12 g.mol-1
e MM(O) = 16 g.mol-1
O composto conhecido como glicol possui uma composição centesimal de 39% de carbono, 51% de oxigênio e 10% de hidrogênio. Dentre as opções a seguir, identifique aquela que pode ser considerada a fórmula mínima do glicol.
Dados: MM(H) = 1 g.mol-1 , MM(C) = 12 g.mol-1 e MM(O) = 16 g.mol-1
A figura abaixo mostra as estruturas químicas das moléculas do propranolol e atenolol, as quais são largamente utilizadas no tratamento da hipertensão.

A análise da figura nos permite concluir que as moléculas apresentam em comum

A análise da figura nos permite concluir que as moléculas apresentam em comum

A figura ao lado mostra três soluções com as respectivas quantidades de solutos, utilizados em sua preparação.
A análise da figura permite concluir que os valores das concentrações a, b e c são, respectivamente,

A figura ao lado mostra três soluções com as respectivas quantidades de solutos, utilizados em sua preparação.
A análise da figura permite concluir que os valores das concentrações a, b e c são, respectivamente,
“Recifes de corais dão suporte a vários vertebrados e invertebrados. A água que os circunda é fundamentalpara sua existência, atuando como solvente para reações bioquímicas e, em grande medida, determinando asestruturas das macromoléculas que realizam essas funções.”VOET, D.; VOET, J. G.; PRATT, C. W. Fundamentos da bioquímica: a vida em nível molecular. 2. ed. Porto Alegre: Artmed, 2008. p. 22.
Sobre a molécula da água e suas propriedades, é CORRETO afirmar:
Sobre a molécula da água e suas propriedades, é CORRETO afirmar:
O sangue humano é considerado um tecido complexo, e a sua capacidade tamponante depende de dois equilíbrios, como descrito a seguir.

Sobre o sangue e o seu sistema tamponado, é CORRETO afirmar:

Sobre o sangue e o seu sistema tamponado, é CORRETO afirmar:
A maneira mais comum de as pessoas adquirirem amebíase, também conhecida como disenteria amebiana, é por meio da ingestão de água ou de alimentos contaminados. Para minimizar a desidratação ocasionada em pessoas que apresentam este quadro, pode ser utilizado o soro fisiológico. No preparo do soro, a partir de 0,900g de NaCl, em 100 mL de solução aquosa, a sua concentração expressa em mol/L-1 é igual a:
As cianobactérias são micro-organismos que apresentam grande capacidade de colonização em diversos habitats e, de acordo com a taxonomia atual, existem pelo menos 40 gêneros que são produtoras de toxinas em ambientes aquáticos, por causa da crescente eutrofização desses ambientes. A saxitoxina, representada abaixo, é uma neurotoxina produzida por algumas espécies de cianobactérias.

Sobre esse assunto, é CORRETO afirmar:

Sobre esse assunto, é CORRETO afirmar:
 que, quando dissolvida em água, confere maior apolaridade à molécula.
que, quando dissolvida em água, confere maior apolaridade à molécula.