Questõesde UEFS 2010 sobre Química
A plataforma de petróleo de uma empresa britânica foi atingida por incêndio, no Golfo do México, em abril de 2010. Ao lançar
fumaça preta na atmosfera e ao derramar petróleo, que se espalhou por quilômetros, nas águas do Golfo, a plataforma explodiu
e submergiu, deixando para trás um dos maiores acidentes causados por vazamento de óleo do mundo.
A partir dessas informações, pode-se concluir:
No Brasil, existem 17 milhões de pessoas portadoras de
hipertensão caracterizada pela pressão arterial igual ou superior
a 14 por 9. O problema é agravado pelo consumo excessivo
de sal, NaCl, que ultrapassa o limite máximo de 5,0g diários.
O excesso provém, em grande parte, dos alimentos
processados, a exemplo de salgadinhos, conservas e frios,
dentre outros.
A partir da análise dos efeitos causados pelo cloreto de sódio
sobre o aumento da pressão arterial no Brasil, é correto afirmar:
A baiana do acarajé, um símbolo da Bahia, é considerada um
bem cultural e imaterial pelo Ministério da Cultura e tem como
o seu dia comemorativo 25 de novembro.
O acarajé, preparado no óleo de dendê aquecido à ebulição,
é um alimento rico em proteínas e carboidratos, de grande valor
nutricional, que só a baiana do acarajé sabe preparar.
A partir dessa informação, é correto afirmar:
HOOCCH2C(OH)CH2COOH
│
COOH
Ácido Cítrico
O ácido cítrico, responsável pela acidez das frutas cítricas, é
utilizado como acidificante e flavorizante no processamento de
alguns alimentos.
A partir dessas informações, é correto afirmar:
A solução aquosa, 1,0.10−2 mol.L−1 , de ácido cítrico completamente ionizada apresenta pH = 2,0.
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka,
dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Em um recipiente de 2,0L, foram misturados 12,0mol de
dióxido de enxofre, SO2(g), com 10,0mol de oxigênio, O2(g), à
determinada temperatura. Após ter sido fechado o recipiente,
e depois de estabelecido o equilíbrio químico, o sistema,
representado pela equação química, apresentou 8,0mol de
trióxido de enxofre, SO3.
A partir dessas informações e da análise do equilíbrio químico
do sistema considerado, é correto afirmar:
H2(g) + I2(g)  2HI(g) v = k[H2] [I2]
2HI(g) v = k[H2] [I2]
O modelo da teoria das colisões, que resultou de estudos dos
fatores que influem na velocidade das reações químicas, é uma
explicação para o modo como as moléculas de reagentes são
clivadas e são formadas as moléculas de produtos de uma
reação química.
Admitindo-se a reação química elementar entre o hidrogênio
e o iodo, a 450oC, representada pela equação química, a
expressão da lei de velocidade dessa reação, e com base na
teoria das colisões, para que essa reação ocorra, dentre outros
fatores, é preciso que
 2HI(g) v = k[H2] [I2]
2HI(g) v = k[H2] [I2]I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor
da Universidade de São Petersburgo, no século XIX, a variação
de entalpia em uma reação química depende apenas dos
estados inicial e final de reagentes e de produtos da reação.
A Lei de Hess contribuiu para o nascimento do princípio da
conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
 ]
]
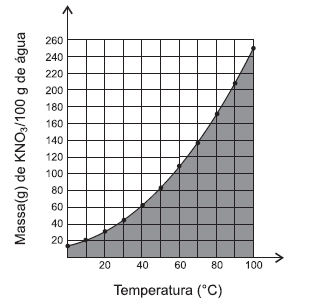
O gráfico representa a variação do coeficiente de solubilidade
de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
 ]
]
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
A hidroquinona, MM =110,0g.mol−1
, é um antioxidante, que
contém dois grupos −OH substituintes, no anel benzênico,
utilizada em alguns cosméticos e na revelação de filmes
fotográficos. A análise de uma amostra dessa substância
química revelou que a composição percentual, em massa,
é 65,4% de carbono, 5,5% de hidrogênio e 29,1% de oxigênio.
Considerando-se as informações do texto e a composição
percentual de hidroquinona, é correto afirmar:
As misturas gasosas são sistemas homogêneos e, por essa
razão, apresentam a mesma composição química em
qualquer ponto do recipiente onde se encontram. Os estudos
de J. Dalton mostraram as relações entre as pressões parciais
com a pressão total dos gases em uma mistura gasosa, e
os trabalhos de Amagat estabeleceram uma relação
semelhante entre os volumes parciais com o volume total.
Assim, considerando-se 100,0g de uma amostra de gases
ideais, que contém 64% de SO2, e 36% de He, em massa
a 27oC, a 1,0atm, no interior de um recipiente, é correto afirmar:
A falta de manejo adequado no sistema de esgotamento
sanitário de Correntina, no oeste baiano, está comprometendo
a eficácia do processo de tratamento de efluentes. O esgoto
é jogado no rio Correntina cerca de 2,0km acima de um
balneário. O sistema de tratamento dispõe de uma lagoa de
decantação e outra de estabilização, em que os raios
ultravioleta matam a maior parte de bactérias. Após esses
estágios, a água, 70% livre de micro-organismos, é jogada ao
rio, quando o sistema é bem manejado.
Uma análise dos aspectos de tratamento de água de esgotos
de Correntina permite afirmar:
I. CaC2(s) + N2(g) 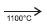 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno
elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá
origem à cianamida de cálcio, empregada largamente como
fertilizante nitrogenado de ação lenta, pois leva alguns meses,
no solo, para se hidrolisar de acordo com a equação
química II. Como a cianamida de cálcio não é arrastada pelas
chuvas, é um fertilizante melhor do que o nitrato de amônio,
NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
I. CaC2(s) + N2(g) 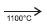 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
O Brasil é o terceiro produtor mundial de pirolusita, MnO2(s),
um minério de manganês. O metal participa da produção de
aços resistentes para fabricação de escavadeiras e de
britadeiras e, sob a forma de íons Mn2+, tem papel importante
na composição de enzimas, a exemplo da arginase produzida
pelo fígado de mamíferos, que converte produtos nitrogenados
em ureia excretada pela urina.
A partir dessas informações e com base nas propriedades
periódicas e de alguns compostos de manganês, é correto
afirmar:
A explicação do espectro atômico dos elementos químicos por
N. Böhr permitiu a construção do modelo atômico que levou
o seu nome. Posteriormente, com o desenvolvimento de
equipamentos mais avançados, foi possível a obtenção de
espectros de raias mais finas, que foram elucidados com o
novo modelo atômico baseado nos subníveis de energia.
Considerando-se essas informações acerca desses modelos
atômicos, é correto afirmar:

No processo Dow, de extração de magnésio, da água do mar,
sob a forma de íons Mg2+(aq), representado pelo fluxograma,
hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar,
para que o Mg(OH)2(s) se precipite, permanecendo os
íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de
magnésio, MgCl2(s), produto final desse processo, esse sal
é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:

No processo Dow, de extração de magnésio, da água do mar, sob a forma de íons Mg2+(aq), representado pelo fluxograma, hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar, para que o Mg(OH)2(s) se precipite, permanecendo os íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de magnésio, MgCl2(s), produto final desse processo, esse sal é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:
O vazamento de petróleo, proveniente de navios petroleiros,
geralmente identificado pelas grandes manchas negras de
óleo sobre a superfície dos mares e sobre a areia de praias
da costa brasileira, vem causando danos irreparáveis à vida
marinha.
A partir dessas informações, é correto afirmar:
O etanol de segunda geração é obtido a partir de resíduos de
biomassa, a exemplo de palhas e bagaço de cana-de-açúcar,
sabugo e palha de milho, ricos em celulose, tratados com
solução diluída de ácido sulfúrico, H2SO4(aq), (Ka1 > 103
e Ka2 = 1,2.10−2
), sob aquecimento.
Esse processo produz inicialmente carboidratos menos
complexos que a celulose, que, ao serem submetidos à
fermentação, produzem etanol. O aproveitamento desses
resíduos de biomassa aumenta em quase 100% a produção
de etanol de cana-de-açúcar.
Uma análise dessas informações permite afirmar:

Em uma xícara de café recém-preparado, há dezenas de
substâncias químicas diferentes. Uma dessas substâncias,
que é formada durante a torrefação do grão de café,
representada pela fórmula estrutural, é responsável pelo odor
característico da bebida.
A partir da fórmula estrutural do tiol, é correto afirmar:

Em uma xícara de café recém-preparado, há dezenas de substâncias químicas diferentes. Uma dessas substâncias, que é formada durante a torrefação do grão de café, representada pela fórmula estrutural, é responsável pelo odor característico da bebida.
A partir da fórmula estrutural do tiol, é correto afirmar:
O íon  CH2S-(aq) é base conjugada do ácido H2O(ℓ),
de acordo com os conceitos de Brönsted-Lowry.
CH2S-(aq) é base conjugada do ácido H2O(ℓ),
de acordo com os conceitos de Brönsted-Lowry.