
Em uma xícara de café recém-preparado, há dezenas de
substâncias químicas diferentes. Uma dessas substâncias,
que é formada durante a torrefação do grão de café,
representada pela fórmula estrutural, é responsável pelo odor
característico da bebida.
A partir da fórmula estrutural do tiol, é correto afirmar:

Em uma xícara de café recém-preparado, há dezenas de substâncias químicas diferentes. Uma dessas substâncias, que é formada durante a torrefação do grão de café, representada pela fórmula estrutural, é responsável pelo odor característico da bebida.
A partir da fórmula estrutural do tiol, é correto afirmar:
O íon é base conjugada do ácido H2O(l),
de acordo com os conceitos de Brönsted-Lowry.
é base conjugada do ácido H2O(l),
de acordo com os conceitos de Brönsted-Lowry.


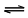 2HBr(g)
2HBr(g)





