a025b96d-a6
UECE 2011 - Química - Química Orgânica, Cadeias Carbônicas: Características e Classificações do Átomo do Carbono, Tipos de Ligação e Hibridação. Tipos de Cadeias Carbônicas e Fórmulas. Séries: Homóloga, Isóloga e Heteróloga.
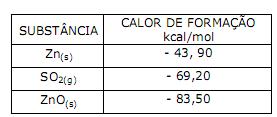
Assinale a alternativa que associa corretamente a fórmula estrutural do composto orgânico com seu nome.
Assinale a alternativa que associa corretamente a fórmula estrutural do composto orgânico com seu nome.
A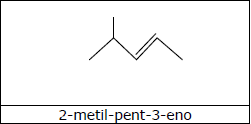

B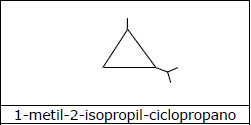

C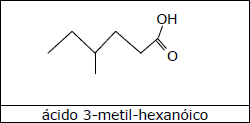

D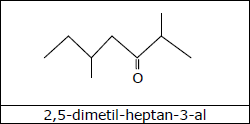

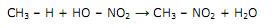
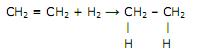
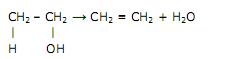
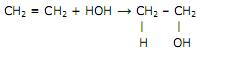
 O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa.
O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa.  é usado para amadurecer de maneira forçada frutas verdes;
é usado para amadurecer de maneira forçada frutas verdes;  é usado na indústria como plasma frio em processos de deposição de materiais;
é usado na indústria como plasma frio em processos de deposição de materiais;  tem o cheiro característico da manteiga rançosa.
tem o cheiro característico da manteiga rançosa. 
 = 10–14 .
= 10–14 .



 é um dissacarídio.
é um dissacarídio.
 A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.
A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.