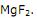80054622-b7
UECE 2010 - Química - Glicídios, Lipídios, Aminoácidos e Proteínas., Química Orgânica, Tipos de Reações Orgânicas: Oxidação, Redução e Polimerização.
Sejam as duas afirmativas:
( ) o nitrobenzeno, composto orgânico
aromático, sofre redução na presença
de H2 para produzir anilina, substância
muito usada na indústria de corantes.
( ) a classe dos glicídios abrange desde o
açúcar comum até compostos muito
complexos, como celulose e
aminoácidos.
Marcando com (V) a afirmativa verdadeira e com
(F) a afirmativa falsa, assinale a sequência correta
de cima para baixo.
Sejam as duas afirmativas:
( ) o nitrobenzeno, composto orgânico
aromático, sofre redução na presença
de H2 para produzir anilina, substância
muito usada na indústria de corantes.
( ) a classe dos glicídios abrange desde o
açúcar comum até compostos muito
complexos, como celulose e
aminoácidos.
Marcando com (V) a afirmativa verdadeira e com
(F) a afirmativa falsa, assinale a sequência correta
de cima para baixo.
Dados que podem ser utilizados na resolução da prova de química
Elemento Número atômico Massa atômica
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
Na 11 23,0
S 16 32,0
Cl 17 35,5
Mn 25 55,0
Pb 82 207,0
A
V, V.
B
F, F.
C
V, F.
D
F, V.






 da água igual a 0,52 °C.kg.mol -1 e sua Kf igual a 1,86 °C.kg.mol -1 , quando adicionamos 18,4 g de glicerol em 500 g de água, os pontos de ebulição e de congelamento da água, serão, nesta ordem, aproximadamente
da água igual a 0,52 °C.kg.mol -1 e sua Kf igual a 1,86 °C.kg.mol -1 , quando adicionamos 18,4 g de glicerol em 500 g de água, os pontos de ebulição e de congelamento da água, serão, nesta ordem, aproximadamente