Arqueólogos e físicos cobiçam igualmente o
chumbo romano antigo existente em antigas
embarcações de naufrágios, estimado em 2 mil anos
de idade. Para os físicos, como o chumbo antigo é
puro, denso e muito menos reativo que o metal
recém-minerado, ele será muito aplicado nos dias de
hoje, entretanto, ele também tem significado
histórico e muitos arqueólogos se opõem ao
derretimento de lingotes. Considerando a
importância desse metal, assinale a afirmação
verdadeira.
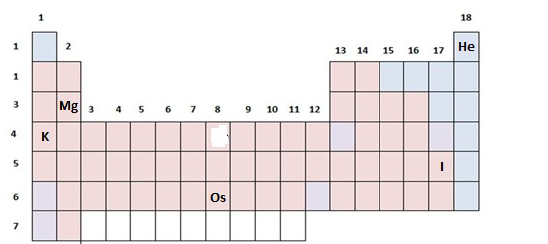
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0