48f5c5c3-0d
CEDERJ 2011 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Transformações Químicas: elementos químicos, tabela periódica e reações químicas, Fórmulas, Balanceamento e Leis ponderais das reações químicas, Transformações Químicas, Representação das transformações químicas
Em relação à reação química Al (s) + O2(g)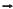 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Em relação à reação química Al (s) + O2(g)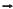 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
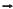 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio éA
11,12 g.
B
13,50 g.
C
20,40 g.
D
27,00 g.
