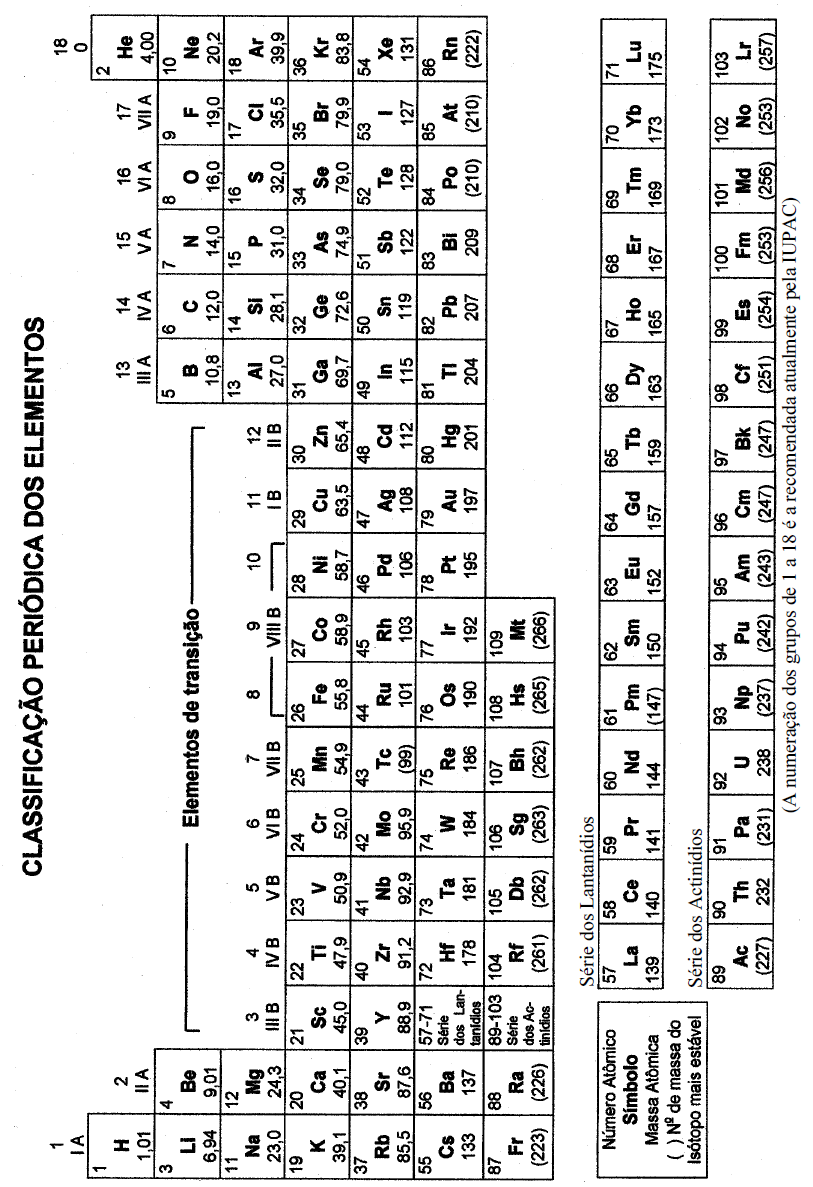
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Em contato com a água, o sódio metálico reage gerando um forte aquecimento, fenômeno
típico de uma reação endotérmica.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm>

 CH
CH