5b8749d3-5e
UFMG 2008 - Química - Cinética Química, Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador, Transformações Químicas e Energia, Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
O propeno,  ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,  e o brometo de isopropila,
e o brometo de isopropila, 
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:

Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,
O propeno,  ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,  e o brometo de isopropila,
e o brometo de isopropila, 
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:

Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,
 ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,  e o brometo de isopropila,
e o brometo de isopropila, 
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:

Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,
A
a energia de ativação é maior.
B
a energia do estado de transição é menor.
C
a energia dos reagentes é maior.
D
a energia liberada na forma de calor é menor.
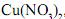 , uma de nitrato de magnésio,
, uma de nitrato de magnésio, , e uma de nitrato de zinco,
, e uma de nitrato de zinco,  .
. 
 liberada na queima do combustível.
liberada na queima do combustível. 
 produzido é o
produzido é o 



 observou-se, durante a dissolução, um resfriamento do sistema
observou-se, durante a dissolução, um resfriamento do sistema aumenta a energia cinética média das moléculas da água.
aumenta a energia cinética média das moléculas da água. dissolvida determina o grau de resfriamento do sistema.
dissolvida determina o grau de resfriamento do sistema. é um processo exotérmico.
é um processo exotérmico.
 .
. 
 diminui a energia cinética média das moléculas de água.
diminui a energia cinética média das moléculas de água. é maior que zero.
é maior que zero.
 são azuis e que as de nitrato de zinco (II),
são azuis e que as de nitrato de zinco (II),  são incolores.
são incolores. 