Questõesde UEMG sobre Soluções e Substâncias Inorgânicas
A análise da água da chuva de uma cidade apresentou uma concentração de
ácido sulfúrico igual a 0,00196 g/L.
Qual a massa, em gramas, de ácido sulfúrico presente em 300 L de água da chuva nessa
cidade?
Qual a massa, em gramas, de ácido sulfúrico presente em 300 L de água da chuva nessa cidade?
O soro fisiológico comercial é preparado com 0,900g de NaCl em 100 mL de
solução aquosa. A massa molar de NaCl é igual a 58,5 g/mol. A concentração do soro
fisiológico, expressa em mol/L, é igual a
Um refresco de limão foi preparado, misturando-se 200mL do suco da fruta
com 200g de açúcar e água suficiente para completar 2 litros. Ao final do preparo, a
concentração de açúcar no refresco, em g/L, será igual a
O suco gástrico, presente no nosso sistema digestivo, contém ácido clorídrico
(HCl), necessário para promover a digestão dos alimentos. No entanto, quando está em
excesso, causa a chamada azia. Para aliviá-la, é comum a ingestão de alguns antiácidos,
como bicarbonato de sódio (NaHCO3l) e leite de magnésia à base de hidróxido de magnésio,
Mg(OH)2. Esses antiácidos
Observe a escala abaixo:

O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre
0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco
de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua
natureza ácida ou básica, de acordo com a escala acima, que relaciona a cor final do sistema
substância + indicador com o pH aproximado que ela possui. Ao testar algumas soluções
com o suco de repolho roxo, foram obtidos os seguintes resultados:
- Amoníaco: verde
- Leite de magnésia: azul
- Vinagre: vermelho
- Leite de vaca: rosa
Com base nessas informações, as substâncias amoníaco, leite de magnésia, vinagre e
leite de vaca têm caráter respectivamente:
Observe a escala abaixo:

O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala acima, que relaciona a cor final do sistema substância + indicador com o pH aproximado que ela possui. Ao testar algumas soluções com o suco de repolho roxo, foram obtidos os seguintes resultados:
- Amoníaco: verde
- Leite de magnésia: azul
- Vinagre: vermelho
- Leite de vaca: rosa
Com base nessas informações, as substâncias amoníaco, leite de magnésia, vinagre e
leite de vaca têm caráter respectivamente:
Um agricultor utilizou CaCO3 (calcário ou carbonato de cálcio) para corrigir o
pH do solo de que fazia uso para plantio. Esse agricultor poderia
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos
que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada
através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou
uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do
ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas
pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
Em um balão volumétrico, foram
adicionados 60 mL de uma solução de
HNO3
de concentração desconhecida
e 40 mL de solução de KOH 0,4 mol/L.
Sabendo-se que o pH final da mistura
é igual a 12, é correto afirmar que a
molaridade da solução de ácido nítrico
era de
Em relação às propriedades de ácidos e
bases e às possíveis reações entre eles,
assinale a alternativa correta.
Ebulioscopia é a propriedade coligativa, relacionada ao aumento da temperatura
de ebulição de um líquido, quando se acrescenta a ele um soluto
não volátil.
Considere as três soluções aquosas a seguir:
Solução A = NaCl 0,1 mol/L
Solução B = sacarose 0,1 mol/L
Solução C = CaCl2 0,1 mol/L
As soluções foram colocadas em ordem crescente de temperatura de
ebulição em
A tabela a seguir informa a percentagem, em massa, do soluto de alguns produtos testados por um aluno:
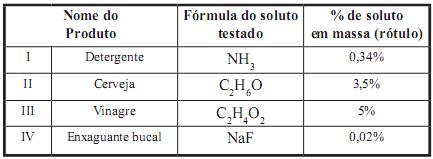
onsiderando que as soluções sejam formadas exclusivamente pelo soluto testado e que suas densidades sejam 1,0 g/mL, o aluno chegou às seguintes conclusões:
I) 1 mol de NH3 em 500 mL de detergente.
II) 21 g de C2 H6 0 em 600 mL de cerveja.
III) 25 g de C2 H4 O2 em 1000 mL de vinagre.
IV) 0,1 mol de NaF em 60 mL de enxaguante bucal.
Assinale a alternativa em que o produto nomeado relaciona CORRETAMENTE a percentagem, em massa, contida no rótulo e os valores encontrados na conclusão do aluno:

onsiderando que as soluções sejam formadas exclusivamente pelo soluto testado e que suas densidades sejam 1,0 g/mL, o aluno chegou às seguintes conclusões:
I) 1 mol de NH3 em 500 mL de detergente.
II) 21 g de C2 H6 0 em 600 mL de cerveja.
III) 25 g de C2 H4 O2 em 1000 mL de vinagre.
IV) 0,1 mol de NaF em 60 mL de enxaguante bucal.
Assinale a alternativa em que o produto nomeado relaciona CORRETAMENTE a percentagem, em massa, contida no rótulo e os valores encontrados na conclusão do aluno: