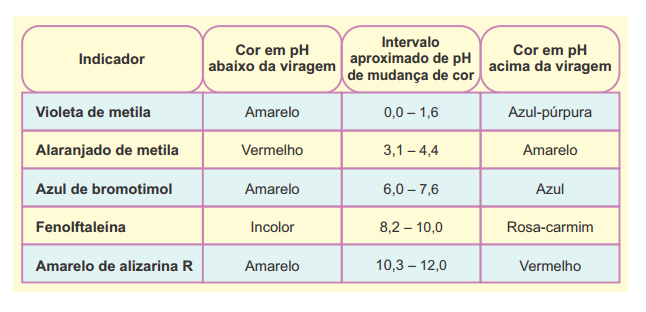
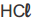Um grupo de alunos estava estudando para as
provas de vestibular e para isso cada um deles
iria explicar uma função inorgânica. O aluno
responsável pela explicação sobre ácidos fez
as seguintes afirmações:
I. Reagem com carbonatos liberando gás
carbônico.
II. Formam soluções não condutoras de
corrente elétrica.
III. Não reagem com metais.
IV. São divididos em hidrácidos e oxiácidos.
• Estão corretas as afirmações:
Um grupo de alunos estava estudando para as provas de vestibular e para isso cada um deles iria explicar uma função inorgânica. O aluno responsável pela explicação sobre ácidos fez as seguintes afirmações:
I. Reagem com carbonatos liberando gás carbônico.
II. Formam soluções não condutoras de corrente elétrica.
III. Não reagem com metais.
IV. São divididos em hidrácidos e oxiácidos.
• Estão corretas as afirmações: