93a50f29-46
PUC - RJ 2013 - Química - Substâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base., Soluções e Substâncias Inorgânicas
Na molécula da amônia, cada átomo de hidrogênio tem
seu elétron comprometido na formação de uma ligação
covalente com o nitrogênio. Por outro lado, o nitrogênio
possui um par de elétrons não ligantes, representado por
dois pontos (:). Existem várias teorias que definem substâncias
como ácido e base. Uma delas é a teoria de Lewis
que pode classificar o :NH3
como base por causa da:
Na molécula da amônia, cada átomo de hidrogênio tem
seu elétron comprometido na formação de uma ligação
covalente com o nitrogênio. Por outro lado, o nitrogênio
possui um par de elétrons não ligantes, representado por
dois pontos (:). Existem várias teorias que definem substâncias
como ácido e base. Uma delas é a teoria de Lewis
que pode classificar o :NH3
como base por causa da:
A
liberação de três íons H+ quando é dissolvido em
água.
B
doação do par de elétrons não ligantes a se combinar.
C
aceitação de íons F- ao reagir com BF3
D
liberação de íons OH- quando na forma gasosa reagir
com gás O2
.
E
formação de íons :NH2 - quando solubilizado e água
ao aceitar um elétron não-ligante a mais.
 H2CO3 (aq)
H2CO3 (aq)
 HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H3O+(aq) CO32-(aq) + H3O+(aq)
CO32-(aq) + H3O+(aq)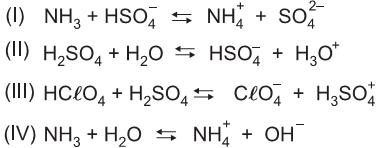
 é base em (I) e ácido em (II).
é base em (I) e ácido em (II).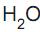 é base em (II) e ácido em (IV).
é base em (II) e ácido em (IV).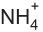 é base em (I) e ácido em (IV).
é base em (I) e ácido em (IV).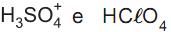 são respectivamente o ácido e a base conjugados de um sistema em (III).
são respectivamente o ácido e a base conjugados de um sistema em (III).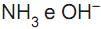 são respectivamente o ácido e a base conjugados de um sistema em (IV)
são respectivamente o ácido e a base conjugados de um sistema em (IV)