Questõesde UNICAMP sobre Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais.
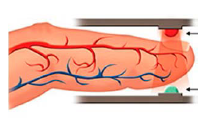
O oxímetro é usado na
triagem para a Covid-19.
Acoplado ao dedo, ele
emite luz em dois
comprimentos de onda
(660 nm e 940 nm) e mede
a quantidade de luz
absorvida (A) em cada caso. A partir disso, determina a
concentração percentual de oxi-hemoglobina (HbO2) e de
desoxi-hemoglobina (Hb) no sangue. Valores entre 95 e
100% para HbO2 indicam normalidade. Simplificadamente,
as quantidades de luz absorvidas em cada comprimento de
onda (A) se relacionam matematicamente às
concentrações [HbO2] e [Hb] conforme as seguintes
equações:
Hb (aq) + O2 (aq) ➝ HbO2 (aq)
A (em 660 nm) = 320 [HbO2] + 3227 [Hb]
A (em 940 nm)= 1214 [HbO2] + 693 [Hb].
Considere que uma pessoa tenha chegado ao hospital com
baixa saturação de O2 no sangue e, depois de submetida à
oxigenoterapia, começa a ter a saturação normalizada. Em
relação às medidas iniciais, quando a saturação de O2
começa a subir, a absorção de luz indicada pelo oxímetro

A forma cristalina de um fármaco é fundamental para seu
uso como medicamento. Assim, a indústria farmacêutica,
após a síntese de determinado fármaco, deve verificar se
ele se apresenta como uma única forma cristalina ou se é
uma mistura polimórfica. Uma das formas de purificar um
fármaco nessas condições é utilizar um processo de
recristalização: dissolução do material sintetizado, seguida
da cristalização da substância desejada. Observe na tabela
abaixo os dados de solubilidade em água de uma dada
forma de insulina.
Temperatura (ºC) Solubilidade (mg mL-1) 15 0,30
25 0,63
35 0,92
A partir dessas informações, caso se queira purificar uma
amostra dessa insulina, seria recomendado dissolver essa
amostra em quantidade suficiente de água
Massas molares em g mol-1: Na = 23; Mg = 24; Cl = 35,5; K = 39; Ca = 40.
Imagine-se como um dos coautores de um trabalho científico sobre a capacidade de dessalinização de fibras de carbono poroso (PCF). Ao revisar os dados da pesquisa, você observa que os resultados apresentados no gráfico a seguir estão consistentes para MgCl2 e CaCl2, do ponto de vista do conhecimento químico.
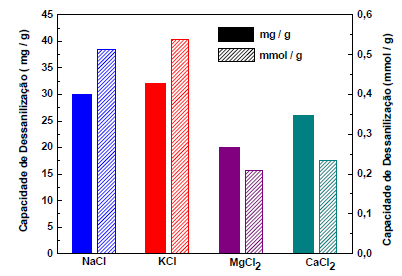
No entanto, você também observa no gráfico que a apresentação dos dados está

Fake News ou não? Hoje em dia, a disponibilidade de
informações é muito grande, mas precisamos saber
interpretá-las corretamente. Um artigo na internet tem o
seguinte título: “Glutamato monossódico, o sabor que
mata!”. Em determinado ponto do texto, afirma-se:
“Só para você ter ideia dos riscos, organizações
internacionais de saúde indicam que a ingestão diária de
sódio para cada pessoa seja de 2,3 gramas. O glutamato é
composto por 21% de sódio e, com certeza, não será o
único tempero a ser acrescentado ao seu almoço ou jantar.
Além disso, o realçador (glutamato) só conta um terço do
nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1
: sódio = 23, cloreto =
35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do
ponto de vista químico, você sugeriria a seguinte reescrita
dos trechos destacados:
Fake News ou não? Hoje em dia, a disponibilidade de informações é muito grande, mas precisamos saber interpretá-las corretamente. Um artigo na internet tem o seguinte título: “Glutamato monossódico, o sabor que mata!”. Em determinado ponto do texto, afirma-se:
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar.
Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1 : sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados:
Dois estudantes, de massa corporal em torno de 75 kg, da
Universidade de Northumbria, no Reino Unido, quase
morreram ao participar de um experimento científico no
qual seriam submetidos a determinada dose de cafeína e a
um teste físico posterior. Por um erro técnico, ambos
receberam uma dose de cafeína 100 vezes maior que a
dose planejada. A dose planejada era de 0,3 g de cafeína,
equivalente a três xícaras de café. Sabe-se que a União
Europeia, onde o teste ocorreu, classifica a toxicidade de
uma dada substância conforme tabela a seguir.

Considerando que a DL50 – dose necessária de uma dada
substância para matar 50% de uma população – da cafeína
é de 192 mg/kg, no teste realizado a dose aplicada foi
cerca de

Episódios recentes de erupções vulcânicas têm trazido
consequências trágicas para a sociedade e para o meio
ambiente. Ativo desde 1983, o Vulcão Kilauea apresentou,
em 2018, a sua maior erupção já registrada. Quase ao
mesmo tempo, foi a vez do Vulcão Fuego da Guatemala
mostrar sua força. No Kilauea não houve explosões, ao
contrário do que ocorreu no Fuego. Os especialistas
afirmam que a ocorrência de uma erupção explosiva
depende da concentração e do tipo de gases dissolvidos
no magma, como SO2, HF e HCl, além de vapor de água e
CO2 aprisionados. A figura a seguir dá informações sobre a
relação entre quantidades (em mol) de SO2, HF e HCl no
magma de três vulcões distintos.

De acordo com a figura, em relação às quantidades de
gases dissolvidos no magma, é correto afirmar que as
concentrações de SO2 são maiores que as de HF e de HCl

Dois estudantes, de massa corporal em torno de 75 kg, da
Universidade de Northumbria, no Reino Unido, quase
morreram ao participar de um experimento científico no
qual seriam submetidos a determinada dose de cafeína e a
um teste físico posterior. Por um erro técnico, ambos
receberam uma dose de cafeína 100 vezes maior que a
dose planejada. A dose planejada era de 0,3 g de cafeína,
equivalente a três xícaras de café. Sabe-se que a União
Europeia, onde o teste ocorreu, classifica a toxicidade de
uma dada substância conforme tabela a seguir.

Considerando que a DL50 – dose necessária de uma dada
substância para matar 50% de uma população – da cafeína
é de 192 mg/kg, no teste realizado a dose aplicada foi
cerca de

As empresas que fabricam produtos de limpeza têm se
preocupado cada vez mais com a satisfação do
consumidor e a preservação dos materiais que estão
sujeitos ao processo de limpeza. No caso do vestuário, é
muito comum encontrarmos a recomendação para fazer o
teste da firmeza das cores para garantir que a roupa não
será danificada no processo de lavagem. Esse teste
consiste em molhar uma pequena parte da roupa e colocá-
la sobre uma superfície plana; em seguida, coloca-se um
pano branco de algodão sobre sua superfície e passa-se
com um ferro bem quente. Se o pano branco ficar
manchado, sugere-se que essa roupa deve ser lavada
separadamente, pois durante esse teste ocorreu um
processo de
Hot pack e cold pack são dispositivos que permitem, respectivamente, aquecer ou resfriar objetos rapidamente e nas mais diversas situações. Esses dispositivos geralmente contêm substâncias que sofrem algum processo quando eles são acionados. Dois processos bastante utilizados nesses dispositivos e suas respectivas energias estão esquematizados nas equações 1 e 2 apresentadas a seguir.
NH4NO3(s)+H2O( l ) →NH4+(aq)+NO3-(aq) ΔΗ = 26 kJ mol-1 1
CaCl2(s)+H2O( l ) →Ca2+ (aq)+2Cl-(aq) ΔΗ = - 82 kJ mol-1 2
De acordo com a notação química, pode-se afirmar que as equações 1 e 2 representam processos de
NH4NO3(s)+H2O( l ) →NH4+(aq)+NO3-(aq) ΔΗ = 26 kJ mol-1 1
CaCl2(s)+H2O( l ) →Ca2+ (aq)+2Cl-(aq) ΔΗ = - 82 kJ mol-1 2
De acordo com a notação química, pode-se afirmar que as equações 1 e 2 representam processos de