5d689cf5-3c
PUC - RJ 2014 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Equilíbrio Químico, Sistemas Homogêneos: Solubilidade dos Sais, Hidrólise dos Sais e Curvas de Titulação., Representação das transformações químicas
A um volume de 1,0 L de efluente industrial contendo íons
Cu2+, adicionou-se excesso de sulfeto de amônio para
precipitar todo o cobre dissolvido na amostra na forma de
CuS. Ao se recolher o precipitado e secá-lo, constatou-se
que a massa era 2,40 g. A concentração, em mol L-1
, que
mais se aproxima da de Cu2+ no efluente é:
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
A um volume de 1,0 L de efluente industrial contendo íons
Cu2+, adicionou-se excesso de sulfeto de amônio para
precipitar todo o cobre dissolvido na amostra na forma de
CuS. Ao se recolher o precipitado e secá-lo, constatou-se
que a massa era 2,40 g. A concentração, em mol L-1
, que
mais se aproxima da de Cu2+ no efluente é:
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
A
0,013
B
0,018
C
0,020
D
0,025
E
0,029
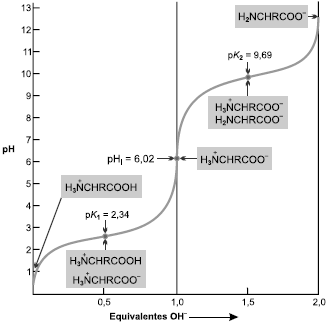
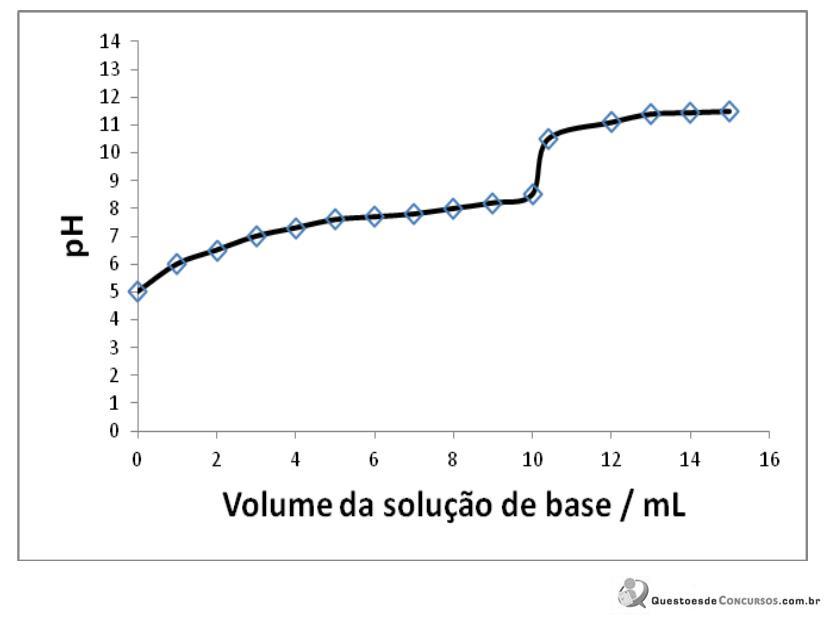
 Esses dois métodos fornecem valores diferentes de pH, nos quais o pH em água é maior em relação ao pH em
Esses dois métodos fornecem valores diferentes de pH, nos quais o pH em água é maior em relação ao pH em  Esse fato ocorre porque
Esse fato ocorre porque é um sal neutro
é um sal neutro dificulta a migra- ção do H+ das partículas do solo para a água.
dificulta a migra- ção do H+ das partículas do solo para a água.


 observou-se, durante a dissolução, um resfriamento do sistema
observou-se, durante a dissolução, um resfriamento do sistema aumenta a energia cinética média das moléculas da água.
aumenta a energia cinética média das moléculas da água. dissolvida determina o grau de resfriamento do sistema.
dissolvida determina o grau de resfriamento do sistema. é um processo exotérmico.
é um processo exotérmico.
 são azuis e que as de nitrato de zinco (II),
são azuis e que as de nitrato de zinco (II),  são incolores.
são incolores. 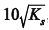 em que Ks é a constante do produto de solubilidade do oleato de cálcio.
em que Ks é a constante do produto de solubilidade do oleato de cálcio.