A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou
quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s).
Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio
de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
 com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio
com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio  de 2,1 x 10-3 mol/L, qual é o valor de
de 2,1 x 10-3 mol/L, qual é o valor de  (constante de ionização ácida) deste ácido?
(constante de ionização ácida) deste ácido? 0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que
0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
 deslocando o equilíbrio para os produtos.
deslocando o equilíbrio para os produtos. deslocando o equilíbrio para os reagentes.
deslocando o equilíbrio para os reagentes. desloca o equilíbrio, aumentando a quantidade de
desloca o equilíbrio, aumentando a quantidade de 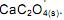
 desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)
desloca o equilíbrio no sentido de aumentar a quantidade de Ca 2+ (aq)
 , cujo valor é 1 x
, cujo valor é 1 x a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
 é menor com a acidificação do meio.
é menor com a acidificação do meio.