1145e173-f5
UFRN 2012 - Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas, Representação das transformações químicas
Uma lei química expressa regularidades dos
processos químicos, permitindo explicá-los e
também fazer previsões de comportamentos
de fenômenos que pertencem ao contexto de
aplicação dessa lei. Por exemplo, a Lei das
Proporções Constantes de Proust expressa
uma das mais importantes regularidades da
natureza. Segundo essa lei,
Uma lei química expressa regularidades dos
processos químicos, permitindo explicá-los e
também fazer previsões de comportamentos
de fenômenos que pertencem ao contexto de
aplicação dessa lei. Por exemplo, a Lei das
Proporções Constantes de Proust expressa
uma das mais importantes regularidades da
natureza. Segundo essa lei,
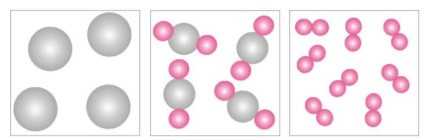
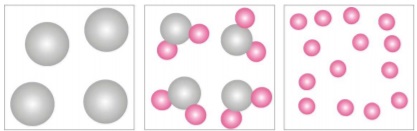
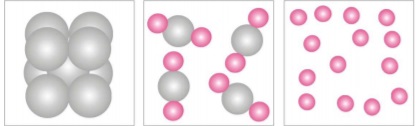
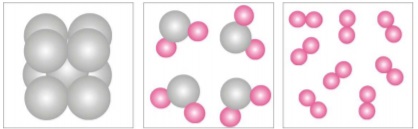
A
a composição química das substâncias
compostas é sempre constante, não
importando qual a sua origem, mas
depende do método utilizado, na indústria
ou no laboratório, para obtê-las.
B
a composição química das misturas é
sempre constante, não importando qual
sua origem mas depende do método
utilizado, na indústria ou no laboratório,
para obtê-las.
C
a composição química das misturas é
sempre constante, não importando qual
sua origem ou o método para obtê-las.
D
a composição química das substâncias
compostas é sempre constante, não
importando qual a sua origem ou o
método para obtê-las.




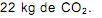

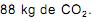




 o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
o volume de nitrogênio gasoso que se obtém é, aproximadamente, de 
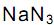 , o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de 

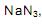 o volume de nitrogênio gasoso que se obtém é, aproximadamente,
o volume de nitrogênio gasoso que se obtém é, aproximadamente,