f5e1a92d-e2
UEPB 2011 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Representação das transformações químicas
O Brasil, querendo assumir uma projeção no cenário diplomático internacional, juntamente com a Turquia, fez um acordo com o Irã sobre o
enriquecimento de Urânio. De fato, o processo de enriquecimento de Urânio significa aumentar o teor do Urânio-235, utilizado em fissão
nuclear. Sabendo que as proporções dos isótopos naturais do Urânio são: 99,27 % de Urânio-238, 0,72 % de Urânio-235 e 0,0055 % de
Urânio-234, qual a Massa Molar do Urânio enriquecido se as quantidades forem 70 % de Urânio-238 e 30 % de Urânio-235?
O Brasil, querendo assumir uma projeção no cenário diplomático internacional, juntamente com a Turquia, fez um acordo com o Irã sobre o
enriquecimento de Urânio. De fato, o processo de enriquecimento de Urânio significa aumentar o teor do Urânio-235, utilizado em fissão
nuclear. Sabendo que as proporções dos isótopos naturais do Urânio são: 99,27 % de Urânio-238, 0,72 % de Urânio-235 e 0,0055 % de
Urânio-234, qual a Massa Molar do Urânio enriquecido se as quantidades forem 70 % de Urânio-238 e 30 % de Urânio-235?
Texto III:
A Organização das Nações Unidas (ONU) instituiu 2011 como o Ano
Internacional da Química, para conscientizar o público sobre as
contribuições dessa ciência ao bem-estar da humanidade, coincidindo
com o centenário do recebimento do Prêmio Nobel de Química por
Marie Curie. O prêmio recebido pela pesquisadora polaca teve como
finalidade homenageá-la pela descoberta dos elementos químicos
Polônio (Po) e Rádio (Ra). Na verdade, este foi o segundo prêmio
Nobel recebido, sendo o primeiro em Física, em 1903, pelas
descobertas no campo da radioatividade. Marie Curie, assim, se
tornou a primeira pessoa a receber dois prêmios Nobel. Como outra
homenagem, desta vez post mortem, os restos mortais de Marie Curie
foram transladados em 1995 para o Panteão de Paris, local onde estão
as maiores personalidades da França, em todos os tempos. Além
disso, o elemento de número atômico 96 recebeu o nome Cúrio (Cm)
em homenagem ao casal Curie, Marie e seu marido Pierre.
A
237,1 g/mol
B
238,03 g/mol
C
237,1 u.m.a.
D
238,03 u.m.a.
E
236,5 g/mol


























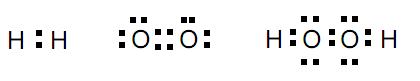
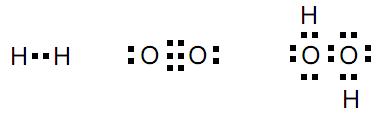
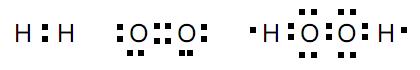


 Al2(CO3)3 + 6 H2O
Al2(CO3)3 + 6 H2O Al3SO4 + H2O
Al3SO4 + H2O Al2(SO4)3 + 6 H2O
Al2(SO4)3 + 6 H2O AlCl3 + H2O
AlCl3 + H2O AlCl3 + 3 H2O
AlCl3 + 3 H2O