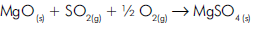f5d47446-e3
UCPEL 2018 - Química - Fórmulas, Balanceamento e Leis ponderais das reações químicas, Representação das transformações químicas
A água oxigenada é uma das substâncias utilizada
em medicina como desinfetante ou agente
esterilizante em autoclave de plasma. No
comércio é vendida em soluções de diferentes
concentrações de peróxido de hidrogênio que
podem ser dosadas por permanganometria
segundo a reação abaixo:

A soma total dos coeficientes dessa equação após
o devido balanceamento é igual a
A água oxigenada é uma das substâncias utilizada
em medicina como desinfetante ou agente
esterilizante em autoclave de plasma. No
comércio é vendida em soluções de diferentes
concentrações de peróxido de hidrogênio que
podem ser dosadas por permanganometria
segundo a reação abaixo:

A soma total dos coeficientes dessa equação após
o devido balanceamento é igual a
A
22
B
24
C
28
D
19
E
32

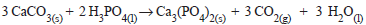
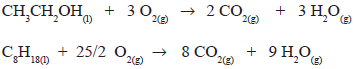

 após o balanceamento, o coeficiente do agente oxidante
será
após o balanceamento, o coeficiente do agente oxidante
será