d7167a3c-c0
PUC - RS 2023 - Química - Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente
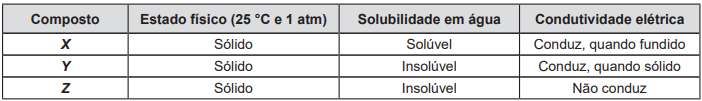
O Acordo de Paris tem por objetivo alcançar a descarbonização do planeta e estabelece como meta limitar o aumento
da temperatura global a 1,5 ºC. Nesse contexto, o hidrogênio verde mostra-se como uma alternativa promissora por
tratar-se de um vetor energético obtido a partir de tecnologia limpa.
O processo de obtenção do hidrogênio verde consiste na decomposição de moléculas de água em oxigênio e hidrogênio
por meio da eletrólise, usando energias renováveis, conforme mostra a figura a seguir.
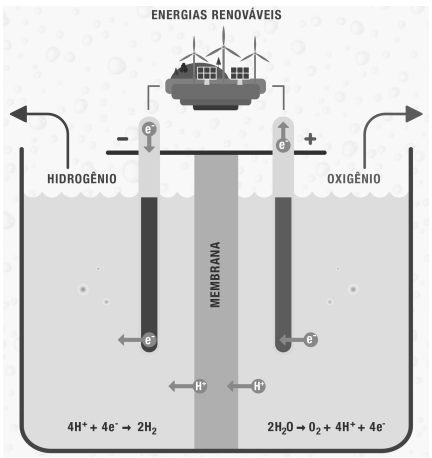
Adaptado de https://www.iberdrola.com/sustentabilidade/hidrogenio-verde.
Com base no processo eletrolítico apresentado na figura, assinale a alternativa correta.
O Acordo de Paris tem por objetivo alcançar a descarbonização do planeta e estabelece como meta limitar o aumento
da temperatura global a 1,5 ºC. Nesse contexto, o hidrogênio verde mostra-se como uma alternativa promissora por
tratar-se de um vetor energético obtido a partir de tecnologia limpa.
O processo de obtenção do hidrogênio verde consiste na decomposição de moléculas de água em oxigênio e hidrogênio
por meio da eletrólise, usando energias renováveis, conforme mostra a figura a seguir.

Adaptado de https://www.iberdrola.com/sustentabilidade/hidrogenio-verde.
Com base no processo eletrolítico apresentado na figura, assinale a alternativa correta.
A
No cátodo ocorre reação de oxidação e no ânodo ocorre reação de redução.
B
O hidrogênio migra para o cátodo e o oxigênio migra para o ânodo.
C
O processo eletrolítico baseia-se em reações espontâneas.
D
O cátodo é o polo positivo e o ânodo é o polo negativo.