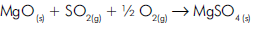Questõessobre Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.

A presença de sais de ferro, a exemplo de bicarbonato de
ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa
manchas de cor marrom quando a água goteja sobre a
superfície de azulejos, pisos e vasos sanitários, em razão da
formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:

A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
A fumaça do cigarro é composta por cerca de 4700 substâncias diferentes. Além da nicotina, na fumaça do cigarro existe uma
substância denominada monóxido de carbono (CO), produzida também por veículos automotores. Esse gás, quando liberado na
atmosfera, reage com o gás oxigênio produzindo dióxido de carbono (CO2). Para se obter 134,4 L de CO2 , são necessários
exatamente quantos mols de CO?
Sabe-se que a reciclagem do alumínio para produção de latinhas, por exemplo, é um processo muito mais barato e eficiente, além de
consumir muito menos energia, do que a sua fabricação a partir do minério de alumínio (Al2O3). Esse metal dissolve-se em ácido
clorídrico, mas não em ácido nítrico que oxida rapidamente a superfície do alumínio e o Al2O3 protege o metal de ataques
subseqüentes. Essa proteção permite que o ácido nítrico seja transportado em tanques de alumínio. Sobre o alumínio, marque V para
as afirmativas verdadeiras e F para as falsas.
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado.
( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à
superfície do metal.
( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols.
( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.
O etanol queima de forma limpa não resultando fuligem, sendo por
isso considerado um combustível ecologicamente correto. É
atualmente a “vedete brasileira” em termos de energia renovável. Qual
o número de átomos de oxigênio comburente necessário para a
combustão de 1,15L de etanol com 95% de pureza?
Considere:
• detanol = 0,8g ⋅ cm−3 • N = 6,00 ×1023
O permanganato de potássio que é utilizado
terapeuticamente na medicina como antisséptico
tópico em pequenas lesões de pele, ao entrar em
contato com ácido clorídrico concentrado, produz
o perigoso gás cloro, conforme a equação não-balanceada:

Ao reagir 158g de KMnO4 com quantidade
suficiente de HCl, qual o volume aproximado de
Cl2
nas condições normais de temperatura e pressão
considerando um rendimento de 80%?
Considere: Volume molar dos gases nas CNTP =
22,7L

Uma empresa produtora de biodiesel, que utiliza o processo de transesterificação mencionado na questão anterior, trabalha
com o seguinte esquema produtivo:
Com base no esquema ao lado, qual é a
quantidade de álcool que poderá ser recuperada
em 16 horas de produção, tomando por base que a
recuperação seja total?

O fosfato tricálcico Ca3
(PO4
)
2
é um composto
essencial para a formação dos dentes e ossos, sendo
utilizado como suplemento mineral, regulador de
acidez entre outros. Conforme a reação abaixo,
obteve-se, em laboratório, 150,15 g do fosfato
tricálcico, quando se utilizou 1,5 mols de carbonato
de cálcio. Considerando a estequiometria da reação
e sabendo-se que foram utilizados reagentes puros,
qual o rendimento da síntese do fosfato tricálcico?
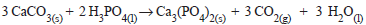
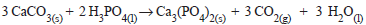
O consumo de combustíveis, como o álcool e a
gasolina, está aumentando e, com isso, também a
eliminação de gás carbônico para a atmosfera. As
reações balanceadas da combustão do etanol e do
iso-octano estão descritas abaixo
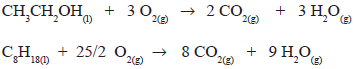
Considerando um tanque de combustível de 55 L,
em que o automóvel A foi abastecido com álcool e
o automóvel B com gasolina, qual o volume
aproximado em L de gás carbônico, nas condições
normais de temperatura e pressão, que será emitido
pelos automóveis, respectivamente?
Considerar:
- Volume molar dos gases nas CNTP, Vm= 22,7 L
- densidade do etanol = 0,8 g.mL-1
- densidade do iso-octano = 0,7 g.mL-1
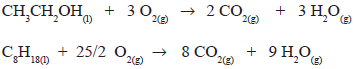
Na reação de oxidação de um composto orgânico
X, foi consumido 128 g de oxigênio, com produção
de 132 g de gás carbônico e 54,06 g de água,
conforme reação abaixo. O composto orgânico X e
os coeficientes estequiométricos para os produtos
seriam, respectivamente,

Na reação de oxidação de um composto orgânico X, foi consumido 128 g de oxigênio, com produção de 132 g de gás carbônico e 54,06 g de água, conforme reação abaixo. O composto orgânico X e os coeficientes estequiométricos para os produtos seriam, respectivamente,

A reação de combustão do butano (C4H10) produz
dióxido de carbono e água. O ar atmosférico contém,
em média, 210 mL/L de oxigênio. Com base nessas
informações, o volume de ar necessário para a
combustão completa de 1,25 g de butano é de,
aproximadamente,
Uma quantidade igual a 5 g de NaCl é dissolvida em
25 g de água. A fração molar em quantidade de matéria
do NaCl na solução é aproximadamente igual a
Uma quantidade igual a 5 g de NaCl é dissolvida em
25 g de água. A fração molar em quantidade de matéria
do NaCl na solução é aproximadamente igual a
Qual é a relação entre as massas de gás oxigênio consumido na combustão completa de um mol, respectivamente, de metanol, etanol e octano?
Na reação: K2
Cr2
O7
+ 14 HCl → 2 KCl + 2 CrCl3
+ 3 Cl2 + 7 H2O o equivalente grama do K2Cr2O7
é
o seu mol dividido por
Uma das formas de medir o grau de intoxicação por
mercúrio em seres humanos é a determinação de sua
presença nos cabelos. A Organização Mundial da Saúde
(OMS) estabeleceu que o nível máximo permissível, sem
risco para a saúde, é de 50 ppm, ou seja, 50 x 10-6 g
de mercúrio por grama de cabelo. Nesse sentido,
podemos afirmar que essa quantidade de mercúrio
corresponde a
Um cientista queria obter seis litros de oxigênio medidos
a 27°C e 0,82 atm e dispunha de nitrato de potássio
que fornece oxigênio por decomposição térmica. A
quantidade de nitrato de potássio que deveria ser usada
para se obter o volume de oxigênio desejado é de
Há algo em comum entre uma garrafa de vidro e uma barra de sabão? A resposta é sim, pois tanto a garrafa quanto o
sabão são feitos com álcalis – nome genérico dos carbonatos e hidróxidos de sódio e potássio. A partir do bicarbonato de
sódio, pode-se preparar dois importantes álcalis, essenciais na produção de vidros e sabões, conforme as reações:
I - 2 NaHCO3  X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
Sobre esse processo, assinale a afirmativa correta.
 X + CO2 + H2O
X + CO2 + H2O
O Protocolo de Kyoto tem como meta a redução da emissão combinada de poluentes atmosféricos em 5% em relação aos
níveis de 1990, no período 2008–2012. Tais poluentes são: CO2; CH4; Hidrofluorcarbonos; Perfluorcarbonos e SF6. Em
2002, a emissão de CO2 pela União Européia foi cerca de 3,5 bilhões de toneladas, que, em mols, representam
aproximadamente
Uma das maneiras de impedir que o SO2, um dos
responsáveis pela chuva ácida, seja liberado para a
atmosfera é tratá-lo previamente com óxido de
magnésio, em presença de ar, como equacionado a
seguir:
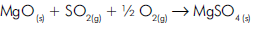
Quantas toneladas de óxido de magnésio são
consumidas no tratamento de 9,6 x 103 toneladas de
SO2
?