f89e7dc1-e3
FPS 2017 - Química - Equilíbrio Químico, Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
Considere uma mistura de PCl5, PCl3 e Cl2 , em equilíbrio a 227 ºC, de acordo com a equação:

As concentrações de PCl3 e Cl2 são 0,01 mol/L e 0,30 mol/L, respectivamente. Sabendo que Kc = 0,006 na mesma temperatura, calcule a concentração de PCl 5 nesse equilíbrio.
Considere uma mistura de PCl5, PCl3 e Cl2 , em equilíbrio a 227 ºC, de acordo com a equação:

As concentrações de PCl3 e Cl2 são 0,01 mol/L e 0,30 mol/L, respectivamente. Sabendo que Kc = 0,006 na mesma temperatura, calcule a concentração de PCl 5 nesse equilíbrio.
A
0,10 mol/L
B
0,20 mol/L
C
0,30 mol/L
D
0,40 mol/L
E
0,50 mol/L







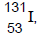 , que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias?
, que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias? 