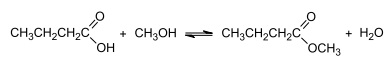65d76317-05
FGV 2020 - Química - Substâncias e suas propriedades, Estudo da matéria: substâncias, misturas, processos de separação.
Em um procedimento de destilação cujo objetivo era recolher o produto em temperaturas baixas, o
recipiente de coleta, submetido inicialmente a 1 atm e à temperatura de 27 °C, foi mergulhado em
um frasco construído com isolamento térmico contendo nitrogênio líquido à temperatura de –196 °C, conforme representado na figura.

Após alcançado o equilíbrio térmico no interior do recipiente de coleta, o valor percentual da
pressão em seu interior, em relação à pressão inicial, será, aproximadamente,
Em um procedimento de destilação cujo objetivo era recolher o produto em temperaturas baixas, o
recipiente de coleta, submetido inicialmente a 1 atm e à temperatura de 27 °C, foi mergulhado em
um frasco construído com isolamento térmico contendo nitrogênio líquido à temperatura de –196 °C, conforme representado na figura.

Após alcançado o equilíbrio térmico no interior do recipiente de coleta, o valor percentual da
pressão em seu interior, em relação à pressão inicial, será, aproximadamente,
A
14%.
B
26%.
C
38%.
D
50%.
E
77%.