Questõesde FATEC sobre Química
A nanotecnologia refere-se à tecnologia utilizada para manipular estruturas muito pequenas, tornando possível
a criação de estruturas funcionais que seriam inconcebíveis utilizando-se tecnologia convencional.
Na formação da palavra Nanotecnologia, o termo “tecnologia” refere-se ao desenvolvimento e produção de
novos materiais, já o prefixo “nano” está relacionado a uma escala de medida em que um nanômetro (nm) é
um bilionésimo do metro.

Dentre as estruturas apresentadas tem-se o grafite, um semimetal que conduz eletricidade e o diamante, um excelente isolante.
Os fulerenos são conhecidos como moléculas semelhantes à bola de futebol. Um fulereno é feito de 60 átomos de
carbono unidos de tal maneira que criam uma esfera oca de 0,7 nm de diâmetro.
Outra estrutura de carbono é o nanotubo no qual os átomos de carbono estão ligados em forma de tubos, ocos como
fulerenos, com diâmetros de uma a várias dezenas de nanômetros.
(www.cienciaviva.org.br – Acesso em 13.03.2010.)
De acordo com o texto, calculando a área da superfície ocupada por um fulereno, tem-se que esta medida é,
em metros quadrados, aproximadamente igual a
1 - Á rea da superfície esférica:
A= 4π r2
2 - Adote π = 3

Uma pizza do tipo portuguesa tem como ingredientes
básicos: massa, molho de tomate, cebola, presunto,
ovos cozidos, azeitonas e orégano. Desses
ingredientes, os que, pela digestão no organismo
humano, fornecem maiores teores de aminoácidos
são
A entalpia de combustão do hidrogênio, H2(g),
considerado por muitos o “combustível do
futuro”, produzindo água no estado gasoso, é
∆H ≈ -3 x 102 kJ/mol.
Caso a combustão desse combustível seja
usada para gerar energia elétrica, a massa de
hidrogênio, que deve ser queimada para fornecer
os 200 kWh que são consumidos por mês em
determinada residência, será aproximadamente,
em quilogramas,
Dados:
1 kWh = 3,6 x 103 kJ
Considere que apenas 50% da
energia da combustão seja convertida em energia elétrica.
Certa solução aquosa de bicarbonato de sódio,
NaHCO3
, apresenta pH = 8,3 a 25º C. Tal solução é
Compostos de cobre (II), entre eles o CuSO4
, são
empregados no tratamento de águas de piscinas
como algicidas. Recomenda-se que a concentração
de CuSO4 não ultrapasse o valor de 1 mg/L nessas
águas.
Sendo assim, considerando uma piscina de formato
retangular que tenha 10 m de comprimento, 5 m
de largura e 2 m de profundidade, quando cheia
de água,a massa máxima de sulfato de cobre que
poderá se dissolver é, em gramas, igual a
Dado:
1m3 = 1 000 L
Para cada molde xenônio que reage completamente,
a massa do produto formado na reação é, em
gramas,
Massas molares em g/mol:
Xe = 131; Pt = 195; F = 19
Sobre essa reação, foram feitas as seguintes
afirmações:
I. O produto da reação é um composto iônico.
II. O átomo de xenônio perde elétron transformando-se em um cátion.
III. O número de prótons do núcleo do átomo de xenônio diminui de uma unidade.
É correto o que se afirma em
Observe a estrutura da fenolftaleína.

Além da função fenol, identificamos o grupo funcional
pertencente à função
Observe a estrutura da fenolftaleína.

Além da função fenol, identificamos o grupo funcional
pertencente à função
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Um aluno da Fatec foi ao laboratório de Química para
realizar esse experimento. Lá ele encontrou apenas uma
solução aquosa de NaOH de concentração 0,5 mol/L.
Para realizar a experiência na concentração descrita
no texto, a partir da solução que ele encontrou, deverá
realizar uma
Um aluno da Fatec foi ao laboratório de Química para realizar esse experimento. Lá ele encontrou apenas uma solução aquosa de NaOH de concentração 0,5 mol/L.
Para realizar a experiência na concentração descrita no texto, a partir da solução que ele encontrou, deverá realizar uma
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
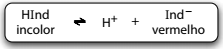
A fenolftaleína atua como um indicador ácido-base por
ser um ácido fraco, que em solução alcóolica, apresenta a
cor das moléculas não-dissociadas, HInd, diferente da cor
dos respectivos íons, Ind–.
A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
A fenolftaleína atua como um indicador ácido-base por ser um ácido fraco, que em solução alcóolica, apresenta a cor das moléculas não-dissociadas, HInd, diferente da cor dos respectivos íons, Ind–.

A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
As soluções de NaOH ou Ca(OH)2, apresentam soluto de
caráter
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Para obtermos 100 mL de uma solução aquosa saturada
de hidróxido de cálcio, Ca(OH)2, para o experimento,
devemos levar em consideração a solubilidade desse
composto.
Sabendo que o produto de solubilidade do hidróxido de
cálcio é 5,5 x 10-6, a 25 °C, a solubilidade dessa base em
mol/L é, aproximadamente,
Dados:
Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Kps = [Ca2+] . [OH–]
2
Para obtermos 100 mL de uma solução aquosa saturada de hidróxido de cálcio, Ca(OH)2, para o experimento, devemos levar em consideração a solubilidade desse composto.
Sabendo que o produto de solubilidade do hidróxido de cálcio é 5,5 x 10-6, a 25 °C, a solubilidade dessa base em mol/L é, aproximadamente,
Dados:
Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Kps = [Ca2+] . [OH–]
2
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A imagem apresenta duas semirreações, sendo uma de um
elemento não metálico. Dada a fila de reatividade de metais:
alcalinos>alcalinoterrosos>Al>Zn>Fe>H2>Cu>Ag>Pt>Au
é correto afirmar que, a substância simples desse elemento
pode ser obtida por meio da reação de
A imagem apresenta duas semirreações, sendo uma de um elemento não metálico. Dada a fila de reatividade de metais:
alcalinos>alcalinoterrosos>Al>Zn>Fe>H2>Cu>Ag>Pt>Au
é correto afirmar que, a substância simples desse elemento pode ser obtida por meio da reação de
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Em 1859, surgiram experimentos para a construção
de uma bateria para acumular energia elétrica, as
baterias de chumbo, que passando por melhorias ao
longo dos tempos, tornaram-se um grande sucesso
comercial especialmente na indústria de automóveis.
Essas baterias são construídas com ácido sulfúrico
e amálgamas de chumbo e de óxido de chumbo
IV, em caixas confeccionadas com o polímero
polipropileno.
<http://tinyurl.com/n6byxmf>Acesso em: 10.04.2015. Adaptado.
O monômero usado na produção desse polímero é o
Em 1859, surgiram experimentos para a construção de uma bateria para acumular energia elétrica, as baterias de chumbo, que passando por melhorias ao longo dos tempos, tornaram-se um grande sucesso comercial especialmente na indústria de automóveis.
Essas baterias são construídas com ácido sulfúrico e amálgamas de chumbo e de óxido de chumbo IV, em caixas confeccionadas com o polímero polipropileno.
A diferença de potencial (∆E0), em volts, gerada por essa
pilha é
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
De acordo com a imagem e as informações fornecidas no texto é correto concluir, a respeito do elemento zinco, que
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Considerando o conjunto de informações apresentadas no texto para o elemento zinco, pode-se afirmar corretamente
que ele é um
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
Independentemente do tipo de atividade exercida em um
laboratório químico, são diversos os riscos existentes nesse
ambiente de trabalho, entre os quais podemos citar os
riscos químicos.
“Risco Químico é o perigo a que determinado indivíduo
está exposto ao manipular produtos químicos que
podem causar-lhe danos físicos ou prejudicar-lhe
a saúde. Os danos físicos relacionados à exposição
química incluem, desde irritação na pele e olhos,
passando por queimaduras leves, indo até aqueles de
maior severidade, causados por incêndio ou explosão.
Os danos à saúde podem advir de exposição de curta
e/ou longa duração, relacionada ao contato de produtos
químicos tóxicos com a pele e olhos, bem como à inalação
de seus vapores, resultando em doenças respiratórias
crônicas, doenças do sistema nervoso, doenças nos
rins e fígado e, até mesmo, alguns tipos de câncer.”
<http://tinyurl.com/lfezqwg>Acesso em: 17.04.2015.
Assinale a alternativa que relaciona corretamente a
característica da substância a um risco químico.
Independentemente do tipo de atividade exercida em um laboratório químico, são diversos os riscos existentes nesse ambiente de trabalho, entre os quais podemos citar os riscos químicos.
“Risco Químico é o perigo a que determinado indivíduo está exposto ao manipular produtos químicos que podem causar-lhe danos físicos ou prejudicar-lhe a saúde. Os danos físicos relacionados à exposição química incluem, desde irritação na pele e olhos, passando por queimaduras leves, indo até aqueles de maior severidade, causados por incêndio ou explosão. Os danos à saúde podem advir de exposição de curta e/ou longa duração, relacionada ao contato de produtos químicos tóxicos com a pele e olhos, bem como à inalação de seus vapores, resultando em doenças respiratórias crônicas, doenças do sistema nervoso, doenças nos rins e fígado e, até mesmo, alguns tipos de câncer.”
Na indústria têxtil, é uma prática comum aplicar goma aos tecidos no início da produção, para torná-los mais resistentes.
Esse produto, entretanto, precisa ser removido posteriormente, no processo de desengomagem. Nesse processo, os
produtos têxteis são mergulhados em um banho aquoso com uma enzima do grupo das amilases.
Os gráficos nas figuras 1 e 2 representam a eficiência da atividade dessa enzima em diferentes valores de temperatura
e pH.

Com base nas informações apresentadas, está correto afirmar que, para se obter a máxima eficiência da ação da enzima no
processo industrial citado no texto, seria necessário manter o banho aquoso de desengomagem a
Na indústria têxtil, é uma prática comum aplicar goma aos tecidos no início da produção, para torná-los mais resistentes. Esse produto, entretanto, precisa ser removido posteriormente, no processo de desengomagem. Nesse processo, os produtos têxteis são mergulhados em um banho aquoso com uma enzima do grupo das amilases.
Os gráficos nas figuras 1 e 2 representam a eficiência da atividade dessa enzima em diferentes valores de temperatura e pH.

Com base nas informações apresentadas, está correto afirmar que, para se obter a máxima eficiência da ação da enzima no
processo industrial citado no texto, seria necessário manter o banho aquoso de desengomagem a