ea169597-d7
FAMERP 2016 - Química - Principais Funções Orgânicas: Funções Oxigenadas: Álcool, Fenol e Enol., Química Orgânica, Principais Funções Orgânicas: Funções Oxigenadas: Cetona, Aldeído, Éter, Éster, Ácido Carboxílico, Anidrido Orgânico e Cloreto de Ácido., Principais Funções Orgânicas: Funções Nitrogenadas: Amina, Amida, Nitrila, Isonitrila e Nitro Composto.
A fórmula corresponde à estrutura do antisséptico cloreto de
benzetônio.

De acordo com a fórmula apresentada, é correto afirmar que
o cloreto de benzetônio é
A fórmula corresponde à estrutura do antisséptico cloreto de
benzetônio.

De acordo com a fórmula apresentada, é correto afirmar que
o cloreto de benzetônio é
A
um sal de amônio quaternário, que apresenta a função
álcool.
B
um sal de amônio quaternário, que apresenta a função
éter.
C
uma amida, que apresenta a função éter.
D
uma amida, que apresenta a função álcool.
E
um sal de amônio quaternário, que apresenta a função
éster.


 Ca
Ca e o átomo
e o átomo 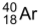 apresentam o mesmo número
apresentam o mesmo número