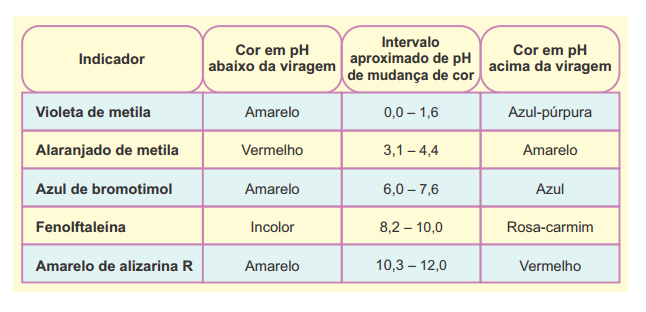
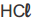Uma das reações utilizadas para a
demonstração de deslocamento de equilíbrio,
devido à mudança de cor, é a representada
pela equação a seguir:

sendo que, o cromato (CrO42- ) possui cor amarela
e o dicromato (Cr2O72- ) possui cor alaranjada.
• Sobre esse equilíbrio foram feitas as seguintes
afirmações:
I. A adição de HCl provoca o deslocamento do
equilíbrio para a direita.
II. A adição de NaOH resulta na cor alaranjada da
solução.
III. A adição de HCl provoca o efeito do íon comum.
IV. A adição de dicromato de potássio não desloca
o equilíbrio.
• As afirmações corretas são:
Uma das reações utilizadas para a demonstração de deslocamento de equilíbrio, devido à mudança de cor, é a representada pela equação a seguir:

sendo que, o cromato (CrO42- ) possui cor amarela e o dicromato (Cr2O72- ) possui cor alaranjada.
• Sobre esse equilíbrio foram feitas as seguintes afirmações:
I. A adição de HCl provoca o deslocamento do equilíbrio para a direita.
II. A adição de NaOH resulta na cor alaranjada da solução.
III. A adição de HCl provoca o efeito do íon comum.
IV. A adição de dicromato de potássio não desloca o equilíbrio.
• As afirmações corretas são: