Os valores de constante de equilíbrio, Kp, referente à reação
da questão anterior, foram determinados experimentalmente em
função da temperatura e estão relacionadas na figura (1), a seguir.
No equilíbrio, a produção de SO3 pode variar em função das condições operacionais. Duas destas condições estão
representadas nas figuras 2 e 3.
A partir destas informações, indique com V as alternativas verdadeiras e com F as alternativas falsas.
( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC, com um valor da constante de equilíbrio, Kp, elevado.
( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, elevado.
( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC com um valor da constante de equilíbrio, Kp, baixo.
( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, baixo.
Assinale a alternativa que indique a seqüência exata:






 SO
SO
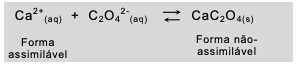


 .
. é P(OH)
é P(OH)



