A pilha de Daniell é composta de duas celas, uma contendo uma placa de cobre, imersa em uma solução de Cu2+ ,
e outra contendo uma placa de zinco imersa numa solução de Zn2+ . As duas placas são conectadas uma a outra
por um fio metálico.As extremidades de uma ponte salina são colocadas nas
soluções das celas. Nessa pilha, em condição padrão, é
fato que


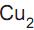 e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.
e CuO) se forma na superfície dos tachos, podendo se desprender e ser incorporado ao doce.  e no CuO são respectivamente 4+ e 2+.
e no CuO são respectivamente 4+ e 2+. é isóbaro do CuO.
é isóbaro do CuO. , a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a:
, a quantidade de eletricidade, em Coulomb, necessária para produzir 21,6 g de alumínio metálico é igual a: