A tecnologia testada mais adequada para o emprego em veículos automotivos é a célula de combustível










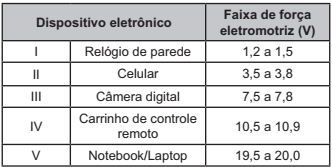






As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas queatuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célulaeletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve forneceruma diferença de potencial mínima para promover a recarga. Quanto maior a diferença depotencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencialpadrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço,
a diferença de potencial mínima, em volt, que ele deve superar é de
Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
3 Ag2S (s) + 2 Al (s) + 8 NaOH (aq) → 6 Ag (s) + 3 Na2S (aq) + 2 NaAlO2 (aq) + 4 H2O (l)
A restauração do objeto de prata ocorre por causa do(a)
Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.

Após a adição de soro sanguíneo, o fluxo desloca- -se espontaneamente da esquerda para a direita (ii) promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:
Equação 1
C6H12O6 (aq) + O2 (g) + H2O (l)  C6H12O7 (aq) + H2O2 (aq)
C6H12O7 (aq) + H2O2 (aq)
Na segunda, o peróxido de hidrogênio reage com íons iodeto gerando o íon tri-iodeto, água e oxigênio.
Equação 2
2 H2O2 (aq) + 3 l− (aq) → I3− (aq) + 2 H2O (I) + O2 (g)
GARCIA, P. T. et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-Based Analytical Devices with Chemically Modified Surface for Clinical Assays. RSC Advances, v. 4, 13 ago. 2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip,
nas duas reações do processo, é
Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando a produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
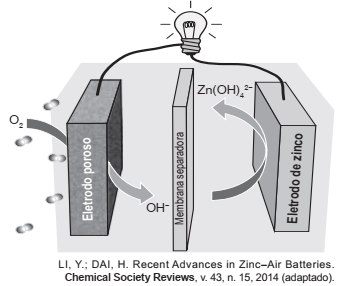
No funcionamento da bateria, a espécie química formada
no ânodo é
Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (Eo) da água e de outras espécies em meio básico, expressos no quadro.
Semirreação de redução Eo (V)
2 H2O + 2 e− → H2 + 2 OH− −0,83
Co(OH)2 + 2 e− → Co + 2 OH− −0,73
Cu(OH)2 + 2 e− → Cu + 2 OH− −0,22
PbO + H2O + 2 e− → Pb + 2 OH− −0,58
Al(OH)4− + 3 e− → Al + 4 OH− −2,33
Fe(OH)2 + 2 e− → Fe + 2 OH− −0,88
Qual é a outra espécie que está presente na composição
da mistura sólida comercial para aumentar sua eficiência?
Al
Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.

A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
O sulfeto de mercúrio(ll) foi usado como pigmento vermelho para pinturas de quadros e murais. Esse pigmento, conhecido como vermilion, escurece com o passar dos anos, fenômeno cuja origem é alvo de pesquisas. Aventou-se a hipótese de que o vermilion seja decomposto sob a ação da luz, produzindo uma fina camada de mercúrio metálico na superfície. Essa reação seria catalisada por íon cloreto presente na umidade do ar.
WOGAN, T. Mercury's Dark Influence on Art. Disponível em: www.chemistryworld.com. Acesso em: 26 abr. 2018 (adaptado).
Segundo a hipótese proposta, o íon cloreto atua na decomposição fotoquímica do vermilion
Em 1938 o arqueólogo alemão Wilhelm Konig, diretor
do Museu Nacional do Iraque, encontrou um objeto
estranho na coleção da instituição, que poderia ter sido
usado como uma pilha, similar às utilizadas em nossos
dias. A suposta pilha, datada de cerca de 200 a.C., é
constituída de um pequeno vaso de barro (argila) no qual
foram instalados um tubo de cobre, uma barra de ferro
(aparentemente corroída por ácido) e uma tampa de
betume (asfalto), conforme ilustrado. Considere os
potenciais-padrão de redução:  (Fe2+|Fe) = -0,44 V;
(Fe2+|Fe) = -0,44 V;
 (H+|H2) = 0,00 V; e
(H+|H2) = 0,00 V; e  (Cu2+|Cu) = +0,34 V.
(Cu2+|Cu) = +0,34 V.

Nessa suposta pilha, qual dos componentes atuaria como
cátodo?