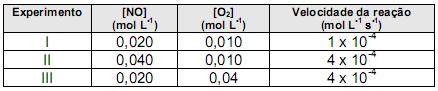
607c0a62-fd
UFT 2019 - Química - Cinética Química, Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
O peróxido de hidrogênio se decompõe lentamente segundo a
reação:

Na presença do íon brometo (Br-
), a decomposição ocorre
rapidamente segundo as reações:
As reações vistas podem ser demonstradas graficamente a
partir de um diagrama de energia potencial:

Em relação à decomposição do H2O2:
I. A reação sem catalisador acontece em apenas uma etapa
e a reação com catalisador acontece em duas etapas,
porém o produto formado é exatamente o mesmo.
II. E1 é a energia de ativação referente à decomposição do
H2O2 na ausência de catalisador e E3 é a energia de
ativação referente à decomposição do H2O2 na presença
de catalisador.
III. E2 é a energia de ativação da etapa determinante da
velocidade da reação catalisada pelo íon Br-
.
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5)
correspondem à energia dos complexos ativados para as
reações representadas.
Assinale a alternativa CORRETA.
O peróxido de hidrogênio se decompõe lentamente segundo a
reação:

Na presença do íon brometo (Br-
), a decomposição ocorre
rapidamente segundo as reações:

As reações vistas podem ser demonstradas graficamente a
partir de um diagrama de energia potencial:

Em relação à decomposição do H2O2:
I. A reação sem catalisador acontece em apenas uma etapa
e a reação com catalisador acontece em duas etapas,
porém o produto formado é exatamente o mesmo.
II. E1 é a energia de ativação referente à decomposição do H2O2 na ausência de catalisador e E3 é a energia de ativação referente à decomposição do H2O2 na presença de catalisador.
II. E1 é a energia de ativação referente à decomposição do H2O2 na ausência de catalisador e E3 é a energia de ativação referente à decomposição do H2O2 na presença de catalisador.
III. E2 é a energia de ativação da etapa determinante da
velocidade da reação catalisada pelo íon Br-
.
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5) correspondem à energia dos complexos ativados para as reações representadas.
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5) correspondem à energia dos complexos ativados para as reações representadas.
Assinale a alternativa CORRETA.
A
Apenas as afirmativas I, II e V estão corretas.
B
Apenas as afirmativas I, III e V estão corretas.
C
Apenas as afirmativas I, III e IV estão corretas.
D
Apenas as afirmativas II, III e V estão corretas.