Um rapaz de 20 anos estava muito gripado e resolveu
tomar vitamina C efervescente de 1g durante três dias.
No primeiro dia ele tomou o comprimido dissolvendo-o
em água de filtro natural (à temperatura ambiente). No
segundo dia só havia água gelada e no terceiro dia foi
utilizada água com gás à temperatura ambiente.
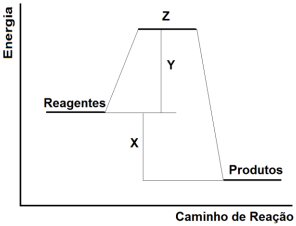
Sabendo-se que o processo de dissolução da vitamina
C efervescente em água ocorre através de uma reação
endotérmica, envolvendo a liberação de CO2. Três
afirmações foram feitas:
1) Na água com gás a velocidade de reação deve
ser menor do que em água natural.
2) Em água gelada a velocidade de reação deve ser
menor que em água natural.
3) No terceiro dia a vitamina C efervescente se
dissolveu mais rápido que nos dias anteriores.
Está(ão) correta(s) apenas:
1) Na água com gás a velocidade de reação deve ser menor do que em água natural.
2) Em água gelada a velocidade de reação deve ser menor que em água natural.
3) No terceiro dia a vitamina C efervescente se dissolveu mais rápido que nos dias anteriores.
Está(ão) correta(s) apenas: