Questõessobre Gás Ideal
Um gás ideal sofre uma compressão isobárica tal que seu
volume se reduz a 2/3 do inicial.
Se a temperatura inicial do gás era de 150 °C, a temperatura
final, em °C, é:
Um gás ideal sofre uma compressão isobárica tal que seu volume se reduz a 2/3 do inicial.
Se a temperatura inicial do gás era de 150 °C, a temperatura final, em °C, é:
Gases, vapores e misturas de gases e vapores, quando
afastados de seus pontos de liquefação, apresentam
um comportamento comum descrito pela equação pV=nRT. Portanto, nas mesmas condições de
pressão e temperatura, esses sistemas, para um
mesmo volume, apresentarão a mesma quantidade
de partículas. Assim, se uma molécula de água ingressar
no ar, alguma outra deverá sair.
Aplicando essas considerações para o ar seco (com
pouco ou nenhum vapor de água) e para o ar úmido
(com vapor de água), afirma-se:
I. O ar úmido é mais denso que o ar seco, pois o
vapor de água (H2O) é mais denso do que o ar seco.
II. O ar úmido é menos denso que o ar seco, porque
a massa da molécula de água é menor do que a
das moléculas de oxigênio (O2
) e nitrogênio (N2
).
III. O ar seco é menos denso que o ar úmido, porque
apresenta menor quantidade de moléculas.
A(s) afirmativa(s) correta(s) é/são:
Gases, vapores e misturas de gases e vapores, quando afastados de seus pontos de liquefação, apresentam um comportamento comum descrito pela equação pV=nRT. Portanto, nas mesmas condições de pressão e temperatura, esses sistemas, para um mesmo volume, apresentarão a mesma quantidade de partículas. Assim, se uma molécula de água ingressar no ar, alguma outra deverá sair.
Aplicando essas considerações para o ar seco (com pouco ou nenhum vapor de água) e para o ar úmido (com vapor de água), afirma-se:
I. O ar úmido é mais denso que o ar seco, pois o vapor de água (H2O) é mais denso do que o ar seco.
II. O ar úmido é menos denso que o ar seco, porque a massa da molécula de água é menor do que a das moléculas de oxigênio (O2 ) e nitrogênio (N2 ).
III. O ar seco é menos denso que o ar úmido, porque apresenta menor quantidade de moléculas.
A(s) afirmativa(s) correta(s) é/são:
Considere um gás ideal, contido em um êmbolo de paredes diatérmica em contato com um banho térmico a uma temperatura T. Aumentando-se a pressão do sistema em duas vezes e meia, a variação percentual de volume do sistema será de
Um gás ideal é submetido aos três processos termodinâmicos descritos no gráfico abaixo.
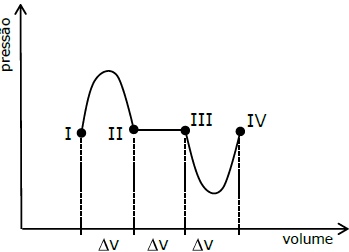
O processo 1 tem estado inicial I e final II, o processo 2 tem estado inicial II e final III, e o processo 3 tem estado inicial III e final IV.
A relação entre os trabalhos Wi (i = 1, 2, 3) nos processos 1, 2 e 3, respectivamente, é melhor estimada por

O processo 1 tem estado inicial I e final II, o processo 2 tem estado inicial II e final III, e o processo 3 tem estado inicial III e final IV.
A relação entre os trabalhos Wi (i = 1, 2, 3) nos processos 1, 2 e 3, respectivamente, é melhor estimada por
Uma pessoa produz, em um ano, 1.562,5 kg de gás carbônico (CO2). Suponha que esta massa de gás seja armazenada no interior de caixas cúbicas de arestas iguais a 1 m, à temperatura de 79 ° C e sob pressão de 1 atm.
Dados:
Massa atômica do Carbono: 12 u
Massa atômica do Oxigênio: 16 u
Constante universal dos gases: 
O número CORRETO de caixas necessário para armazenar a massa de gás carbônico produzida por esta pessoa durante um ano é:
Dados:
Massa atômica do Carbono: 12 u
Massa atômica do Oxigênio: 16 u
Constante universal dos gases:

O número CORRETO de caixas necessário para armazenar a massa de gás carbônico produzida por esta pessoa durante um ano é:
Uma das atrações de um parque de diversões é a barraca de tiro ao alvo, onde espingardas de ar comprimido lançam rolhas contra alvos, que podem ser derrubados.
Ao carregar uma dessas espingardas, um êmbolo comprime 120 mL de ar atmosférico sob pressão de 1 atm, reduzindo seu volume para 15 mL. A pressão do ar após a compressão será, em atm,
Admita que o ar se comporte como um gás ideal e que o processo seja isotérmico.
Ao carregar uma dessas espingardas, um êmbolo comprime 120 mL de ar atmosférico sob pressão de 1 atm, reduzindo seu volume para 15 mL. A pressão do ar após a compressão será, em atm,
Admita que o ar se comporte como um gás ideal e que o processo seja isotérmico.
Considerando-se uma temperatura fixa, a pressão parcial do gás oxigênio na atmosfera em Brasília é inferior à verificada ao nível do mar, mas a fração em quantidade de matéria do gás é a mesma.

Uma dada quantidade de um gás ideal é armazenada em um recipiente de volume fixo, de paredes não condutoras de calor, e a uma temperatura T constante. Suponha que outra porção do mesmo gás, com massa igual à primeira, seja colocada em outro recipiente, também de paredes não condutoras de calor, e à mesma temperatura do primeiro. Entretanto, o volume do segundo recipiente é igual a x% do volume do primeiro. Pode-se afirmar corretamente que a razão entre a pressão do gás no segundo recipiente e a pressão no primeiro é
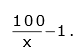
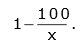
Um laboratório químico descartou um frasco de éter, sem perceber que, em seu interior, havia ainda um resíduo de 7,4 g de éter, parte no estado líquido, parte no estado gasoso. Esse frasco, de 0,8 L de volume, fechado hermeticamente, foi deixado sob o sol e, após um certo tempo, atingiu a temperatura de equilíbrio T = 37 o C, valor acima da temperatura de ebulição do éter. Se todo o éter no estado líquido tivesse evaporado, a pressão dentro do frasco seria

Um estudante contou ao seu professor de Física que colocou uma garrafa PET vazia, fechada, no freezer de sua casa. Depois de algum tempo, abriu o freezer e verificou que a garrafa estava amassada. Na primeira versão do estudante, o volume teria se reduzido de apenas 10% do volume inicial; em uma segunda versão, a redução do volume teria sido bem maior, de 50%. Para avaliar a veracidade dessa história, o professor aplicou à situação descrita a Lei Geral dos Gases Perfeitos, fazendo as seguintes hipóteses, que admitiu verdadeiras:
– a garrafa foi bem fechada, à temperatura ambiente de 27 ºC, e não houve vazamento de ar;
– a temperatura do freezer era de –18 ºC;
– houve tempo suficiente para o equilíbrio térmico;
– a pressão interna do freezer tem de ser menor do que a pressão ambiente (pressão atmosférica).
Assim, o professor pôde concluir que o estudante:
– a garrafa foi bem fechada, à temperatura ambiente de 27 ºC, e não houve vazamento de ar;
– a temperatura do freezer era de –18 ºC;
– houve tempo suficiente para o equilíbrio térmico;
– a pressão interna do freezer tem de ser menor do que a pressão ambiente (pressão atmosférica).
Assim, o professor pôde concluir que o estudante:
Os histogramas a seguir mostram o calor Q e o trabalho W trocados por um gás com o meio externo, bem como a variação da sua energia interna  . O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.
. O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.

De acordo com os respectivos histogramas, em ordem de apresentação, de cima para baixo, os processos podem ser:
 . O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.
. O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.
De acordo com os respectivos histogramas, em ordem de apresentação, de cima para baixo, os processos podem ser: