Questõessobre 1ª Lei da Termodinâmica
O gráfico abaixo representa um processo termodinâmico hipotético, no qual certa massa de gás sofre a transformação cíclica, U→E→G→O→I→A→S→U ,

Em relação a essa transformação, é INCORRETO afirmar:

Em relação a essa transformação, é INCORRETO afirmar:
Monte Fuji

O topo da montanha é gelado porque o ar quente da
base da montanha, regiões baixas, vai esfriando à medida
que sobe. Ao subir, o ar quente fica sujeito a pressões
menores, o que o leva a se expandir rapidamente e,
em seguida, a se resfriar, tornando a atmosfera no topo
da montanha mais fria que a base. Além disso, o principal
aquecedor da atmosfera é a própria superfície da
Terra. Ao absorver energia radiante emitida pelo Sol, ela
esquenta e emite ondas eletromagnéticas aquecendo o
ar ao seu redor. E os raios solares que atingem as regiões
altas das montanhas incidem em superfícies que
absorvem quantidades menores de radiação, por serem
inclinadas em comparação com as superfícies horizontais
das regiões baixas. Em grandes altitudes, a quantidade
de energia absorvida não é suficiente para aquecer o ar
ao seu redor.
(http://super.abril.com.br. Adaptado.)
Segundo o texto e conhecimentos de física, o topo da
montanha é mais frio que a base devido

O topo da montanha é gelado porque o ar quente da base da montanha, regiões baixas, vai esfriando à medida que sobe. Ao subir, o ar quente fica sujeito a pressões menores, o que o leva a se expandir rapidamente e, em seguida, a se resfriar, tornando a atmosfera no topo da montanha mais fria que a base. Além disso, o principal aquecedor da atmosfera é a própria superfície da Terra. Ao absorver energia radiante emitida pelo Sol, ela esquenta e emite ondas eletromagnéticas aquecendo o ar ao seu redor. E os raios solares que atingem as regiões altas das montanhas incidem em superfícies que absorvem quantidades menores de radiação, por serem inclinadas em comparação com as superfícies horizontais das regiões baixas. Em grandes altitudes, a quantidade de energia absorvida não é suficiente para aquecer o ar ao seu redor.
(http://super.abril.com.br. Adaptado.)
Segundo o texto e conhecimentos de física, o topo da montanha é mais frio que a base devido
O desenvolvimento de teorias científicas, geralmente, tem
forte relação com contextos políticos, econômicos, sociais e
culturais mais amplos. A evolução dos conceitos básicos da
Termodinâmica ocorre, principalmente, no contexto
Certa quantidade de gás sofre três transformações sucessivas, A → B, B → C e C → A, conforme o diagrama p-V apresentado na figura abaixo.

A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A՜B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
Note e adote:
o gás deve ser tratado como ideal a transformação B →C é isotérmica.
Certa quantidade de gás sofre três transformações sucessivas, A → B, B → C e C → A, conforme o diagrama p-V apresentado na figura abaixo.

A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A՜B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
Note e adote:
o gás deve ser tratado como ideal a transformação B →C é isotérmica.
Ar contido num cilindro com pistão sofre uma compressão
adiabática, indo do estado (1,00atm ; 20,0L ;
300K) para o estado (66,3atm ; 1,00L ; 994K), resultando
num trabalho de -11,7kJ.
Assumindo que o ar se comporte como um gás ideal,
se a compressão entre os mesmos volumes inicial e
final indicados no processo adiabático tivesse sido
isotérmica, os valores finais de pressão e temperatura
e a variação da energia interna teriam sido, respectivamente,
Ar contido num cilindro com pistão sofre uma compressão adiabática, indo do estado (1,00atm ; 20,0L ; 300K) para o estado (66,3atm ; 1,00L ; 994K), resultando num trabalho de -11,7kJ.
Assumindo que o ar se comporte como um gás ideal, se a compressão entre os mesmos volumes inicial e final indicados no processo adiabático tivesse sido isotérmica, os valores finais de pressão e temperatura e a variação da energia interna teriam sido, respectivamente,
Uma certa quantidade de um gás ideal passa por um processo termodinâmico tal que seu volume dobra enquanto sua pressão cai a um quarto de seus valores iniciais.
Sabendo que a temperatura inicial do gás é 300 K, a sua temperatura final, em K, é:
Uma certa quantidade de um gás ideal passa por um processo termodinâmico tal que seu volume dobra enquanto sua pressão cai a um quarto de seus valores iniciais.
Sabendo que a temperatura inicial do gás é 300 K, a sua temperatura final, em K, é:
Um sistema de pistão contendo um gás é mostrado na figura. Sobre a extremidade superior do êmbolo, que pode movimentar-se livremente sem atrito, encontra-se um objeto. Através de uma chapa de aquecimento é possível fornecer calor ao gás e, com auxílio de um manômetro, medir sua pressão. A partir de diferentes valores de calor fornecido, considerando o sistema como hermético, o objeto elevou-se em valores Ah, como mostrado no gráfico. Foram estudadas, separadamente, quantidades equimolares de dois diferentes gases, denominados M e V.

A diferença no comportamento dos gases no experimento decorre do fato de o gás M, em relação ao V, apresentar

A diferença no comportamento dos gases no experimento decorre do fato de o gás M, em relação ao V, apresentar
Um gás ideal se expande em um processo isotérmico constituído por quatro etapas: I, II, III e IV, conforme a figura abaixo.
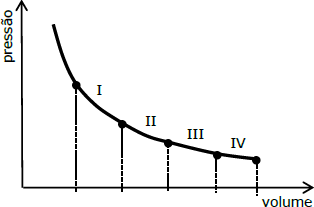
As variações de volume ΔV nas etapas são todas iguais. A etapa onde ocorre maior troca de calor é a

As variações de volume ΔV nas etapas são todas iguais. A etapa onde ocorre maior troca de calor é a
Na figura a seguir , quando o sistema vai do estado a até o estado c ao longo do caminho abc, um calor igual a 85 J flui para o interior do sistema; e um trabalho de 57 J é realizado pelo sistema. Quando o sistema retorna de c para a ao longo do caminho encurvado, o valor absoluto do trabalho realizado sobre o sistema é 10 J.

Qual o valor do calor liberado/absorvido durante a transformação de c para a ao longo do caminho encurvado?
Considere o sinal + para calor absorvido e - para calor liberado na resposta.

Qual o valor do calor liberado/absorvido durante a transformação de c para a ao longo do caminho encurvado?
Considere o sinal + para calor absorvido e - para calor liberado na resposta.
Um automóvel possui uma mistura aquosa em seu sistema de arrefecimento. Essa mistura é bombeada fazendo circular o calor do motor até o radiador, onde o calor é dissipado para o meio ambiente. Um motorista liga o motor desse automóvel e parte para sua viagem. Decorridos 10 minutos, ele observa, no indicador de temperatura do painel, que a mistura chega ao radiador com 90 °C e permanece em torno desse valor durante a viagem. Isso ocorre porque
Motores de automóveis à gasolina são conhecidos como motores de quatro estágios. O cilindro possui uma válvula de admissão (a), uma de escapamento (b) e uma vela (c) que é um dispositivo destinado a produzir uma centelha, que provoca a ignição ou explosão no momento oportuno. A mistura construída de gasolina e ar chega, através da válvula (a), até a câmara de explosão. Um esquema do cilindro do motor e o ciclo de operação ideal de um motor de combustão interna à gasolina estão representados abaixo.

Sobre os processos de 3 a 4 e de 4 a 1 apresentados no ciclo acima, é correto afirmar, respectivamente, que

Sobre os processos de 3 a 4 e de 4 a 1 apresentados no ciclo acima, é correto afirmar, respectivamente, que
A temperatura de um sistema pode ser alterada, quando ele troca trabalho ou calor com sua vizinhança. Seja um sistema constituído por um gás no interior de um cilindro, dotado de êmbolo móvel.
Assinale, abaixo, a alternativa com a descrição CORRETA da situação em que a temperatura do sistema irá diminuir:
Assinale, abaixo, a alternativa com a descrição CORRETA da situação em que a temperatura do sistema irá diminuir:
A vida na Terra começou com seres vivos unicelulares e, com o passar do tempo, foi se complexificando, tornando-se mais organizada. Considerando o ambiente em que a vida se desenvolveu na Terra como um sistema aberto, foram feitas algumas afirmativas no âmbito da Termodinâmica: I — O desenvolvimento da vida na Terra exige uma revisão do Segundo Princípio da Termodinâmica, pois em qualquer sistema aberto a entropia sempre aumenta. II — O desenvolvimento da vida na Terra está de acordo com o Segundo Princípio da Termodinâmica, pois em qualquer sistema aberto a entropia sempre diminui. III — A auto-organização dos seres vivos contribui necessariamente para o aumento da entropia do resto do universo.
Em relação ao valor de verdade das afirmativas, é correto afirmar que :
Em relação ao valor de verdade das afirmativas, é correto afirmar que :
O gráfico a seguir mostra três isotermas para um gás ideal que se encontra num sistema fechado, no qual as diferenças de temperatura entre isotermas consecutivas são iguais, ou seja, T3 - T2 = T2 - T1. Neste gráfico, são indicados quatro processos termodinâmicos para esse gás: 1 e 2 são isobáricos, 3 e 4 são isométricos.

Com base nas informações disponibilizadas no gráfico, afirma- se:
I. No processo 2, a variação da energia interna do gás é maior do que no processo 4.
II. No processo 2, o trabalho realizado é menor do que no processo 3.
III. No processo 2, a variação da energia interna do gás é maior do que no processo 3.
IV. No processo 4, a variação da energia interna é igual ao calor trocado com o meio.
Estão corretas apenas as afirmativas

Com base nas informações disponibilizadas no gráfico, afirma- se:
I. No processo 2, a variação da energia interna do gás é maior do que no processo 4.
II. No processo 2, o trabalho realizado é menor do que no processo 3.
III. No processo 2, a variação da energia interna do gás é maior do que no processo 3.
IV. No processo 4, a variação da energia interna é igual ao calor trocado com o meio.
Estão corretas apenas as afirmativas
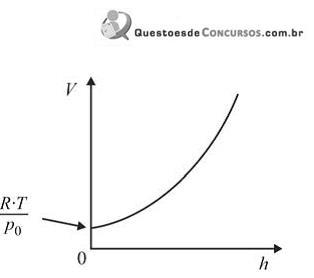
Assinale a opção que apresenta o gráfico que melhor descreve o comportamento do volume molar ( V) de um gás ideal em função da altitude ( h).
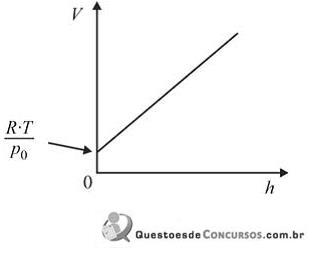
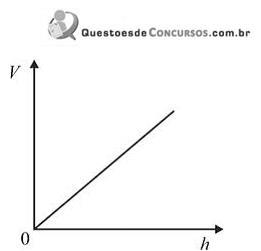
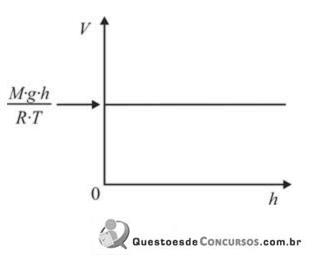
Numa aula de Física, o Professor Carlos Heitor apresenta a seus alunos esta experiência: dois blocos – um de alumínio e outro de ferro –, de mesma massa e, inicialmente, à temperatura ambiente, recebem a mesma quantidade de calor, em determinado processo de aquecimento.
O calor específico do alumínio e o do ferro são, respectivamente, 0,90 J / (g °C) e 0,46 J / (g °C).
Questionados quanto ao que ocorreria em seguida, dois dos alunos, Alexandre e Lorena, fazem, cada um deles, um comentário:
• Alexandre: “Ao final desse processo de aquecimento, os blocos estarão à mesma temperatura.”
• Lorena: “Após esse processo de aquecimento, ao se colocarem os dois blocos em contato, fluirá calor do bloco de ferro para o bloco de alumínio.”
Considerando-se essas informações, é CORRETO afirmar que
O calor específico do alumínio e o do ferro são, respectivamente, 0,90 J / (g °C) e 0,46 J / (g °C).
Questionados quanto ao que ocorreria em seguida, dois dos alunos, Alexandre e Lorena, fazem, cada um deles, um comentário:
• Alexandre: “Ao final desse processo de aquecimento, os blocos estarão à mesma temperatura.”
• Lorena: “Após esse processo de aquecimento, ao se colocarem os dois blocos em contato, fluirá calor do bloco de ferro para o bloco de alumínio.”
Considerando-se essas informações, é CORRETO afirmar que
Analise as assertivas e assinale a alternativa correta.
I. O gás sofre uma transformação isocórica para ir de A até B.
II. A variação da energia interna do gás só depende da variação da temperatura.
III. O trabalho realizado pelo gás é obtido calculando a área do retângulo ABCD.
IV. A energia interna do gás não varia quando o gás passa do estado A para o estado D. V. A temperatura em TD é igual a (P1/P2)TA.
I. O gás sofre uma transformação isocórica para ir de A até B.
II. A variação da energia interna do gás só depende da variação da temperatura.
III. O trabalho realizado pelo gás é obtido calculando a área do retângulo ABCD.
IV. A energia interna do gás não varia quando o gás passa do estado A para o estado D. V. A temperatura em TD é igual a (P1/P2)TA.

Num motor que opera segundo este ciclo, um pistão inicialmente na posição correspondente ao máximo volume, estado 1, comprime o ar até que atinja o volu- me mínimo, estado 2. Então ocorre a combustão, resultando em um súbito aumento da pressão enquanto o volume permanece constante, levando o ar ao estado 3. O processo que segue é a ejeção de potência quando o ar expande adiabaticamente para o estado 4. No processo final, calor é transferido para a vizi- nhança e o ciclo é completado.
A partir das informações obtidas pela análise do gráfico representativo do ciclo Otto e de acordo com as leis da termodinâmica, é correto afirmar que:
A partir das informações obtidas pela análise do gráfico representativo do ciclo Otto e de acordo com as leis da termodinâmica, é correto afirmar que:

A figura representa uma amostra de um gás, suposto ideal, contida dentro de um cilindro. As paredes laterais e o êmbolo são adiabáticos; a base é diatérmica e está apoiada em uma fonte de calor.

Considere duas situações:
I. o êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante;
II. o êmbolo é fixo, mantendo o gás a volume constante. Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar

Considere duas situações:
I. o êmbolo pode mover-se livremente, permitindo que o gás se expanda à pressão constante;
II. o êmbolo é fixo, mantendo o gás a volume constante. Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar
Suponha que nas duas situações a mesma quantidade de calor é fornecida a esse gás, por meio dessa fonte. Pode-se afirmar que a temperatura desse gás vai aumentar