Reações Orgânicas: Substituição, Adição e Eliminação.
Publicado em: 30/11/2022As reações orgânicas são transformações químicas envolvendo compostos orgânicos. Por isso, diferente das reações inorgânicas que ocorrem com espécies iônicas, as reações orgânicas são moleculares. Nesse último caso, a reação ocorre mediante a quebra das ligações das moléculas dos reagentes para formar novas ligações dos produtos, o que torna esse tipo de reação mais lento. Essas reações envolvendo moléculas são muito aplicadas em processos da indústria de polímeros, alimentícia, farmacêutica, entre outras. Elas são classificadas em três tipos principais: substituição, adição e eliminação.
REAÇÕES DE SUBSTITUIÇÃO
Nas reações de substituição, uma parte da molécula (um átomo ou um grupo de átomos) é substituída por outro átomo (ou grupo de átomos).

SUBSTITUIÇÃO EM ALCANOS
Os alcanos têm baixa reatividade, mas sob determinadas condições, tendem a participar de reações de substituição. Nos alcanos, as substituições mais importantes são: halogenação, nitração e sulfonação.
- Na halogenação de um alcano, um ou mais átomos de hidrogênio são substituídos por um ou mais halogênios e formam-se um haleto e ácido do respectivo halogênio.



Moléculas menores de alcanos são destruídas na reação de sulfonação.
De forma geral, na reação de halogenação, uma porção da molécula é substituída por um halogênio, especificamente Cl e Br. Como o flúor é muito reativo, a violenta reação pode destruir a molécula orgânica. Por outro lado, o iodo é pouco reativo, inviabilizando a reação.
Sob aquecimento ou quando exposta à radiação ultravioleta, ocorre a reação de substituição, como exemplificado com a molécula de etano a seguir.

Se houver halogênio em excesso, sucessivas substituições podem ocorrer.
Além disso, outro aspecto relevante desse tipo de reação orgânica é que a halogenação, a nitração e sulfonação de alcanos com 3 ou mais carbonos produz uma mistura de isômeros. Por exemplo, considere a molécula representada a seguir:

A substituição do átomo de hidrogênio por um halogênio, um grupo nitro ou um grupo sulfônico ocorre mais rapidamente nos átomos de carbono 1 e 5, pois são terciários e formam radicais iguais. A ligação entre o átomo de hidrogênio e um carbono terciário é mais fraca e, assim, a substituição ocorre mais rapidamente que em carbonos secundários ou primários. Contudo, é importante considerar que o carbono 4 não é igual aos carbonos 1 e 2, pois eles estão ligados a carbonos de estabilidades diferentes e, portanto, formam radicais diferentes.
Portanto, a facilidade de liberação de hidrogênio na molécula está relacionada com o tipo de carbono presente na cadeia. Quanto maior o número de carbonos ligados a um mesmo carbono, maior a estabilidade das ligações deste carbono com o(s) hidrogênio(s). A estabilidade da ligação C╾H aumenta de acordo com a seguinte ordem:
carbono primário < carbono secundário < carbono terciário.
SUBSTITUIÇÃO EM AROMÁTICOS
A molécula de benzeno é um núcleo aromático em que todos os átomos de carbono estão ligados a um átomo de hidrogênio, conforme demonstrado na estrutura a seguir:

Nas reações de substituição, um ou mais átomos de hidrogênio dão lugar a um grupo substituinte. Neste caso, as reações de substituição podem ser, além de halogenação, nitração e sulfonação, alquilação e acilação.



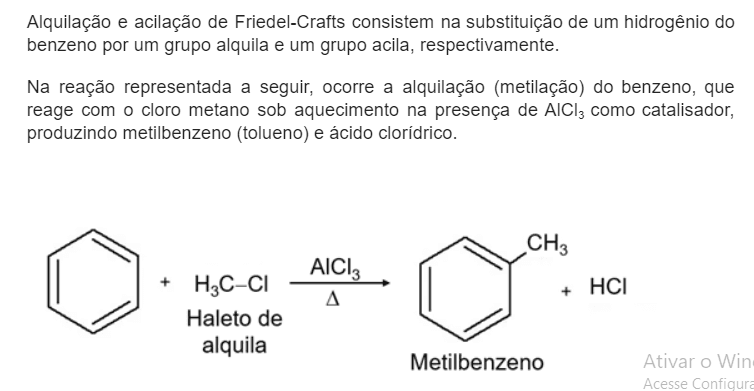

REAÇÕES DE ADIÇÃO
As reações de adição ocorrem em consequência da quebra de uma ou mais ligações p de uma molécula de cadeia insaturada, resultando em ligações simples onde são adicionados os novos grupos. Portanto, as adições geralmente ocorrem em moléculas que apresentam ligações C=C, CºC e C=O.
ADIÇÃO EM ALCENOS
As reações de adição em alcenos ocorre a partir da quebra da ligação p da dupla C=C, para adicionar hidrogênio (hidrogenação catalítica), halogênio (halogenação), haleto de hidrogênio (hidro-halogenação) ou água (hidratação) à molécula.




A adição de haleto de hidrogênio ou de água a um alceno de cadeia não simétrica pode gerar produtos diferentes. Por exemplo, na adição de HCl à molécula do buteno, representada a seguir, o Cl seria adicionado no carbono 1 ou 2?

Nessa situação, aplica-se a regra de Markovnikov: na adição de um haleto de hidrogênio ou de água à ligação C=C, o átomo de H é adicionado preferencialmente ao carbono mais hidrogenado (que apresenta maior quantidade de átomos de hidrogênio ligados ao carbono) da dupla.
Portanto, o Cl seria adicionado ao carbono 2, preferencialmente.
ADIÇÃO EM ALCINOS
Em alcinos, as reações de adição podem ser de hidrogenação e hidro-halogenação. Nesse caso, a hidrogenação pode ser parcial (produzindo um alceno) ou total (produzindo um alcano). Assim como na hidrogenação de alcenos, a reação ocorre sob aquecimento e na presença de um catalisador.
A adição de haletos de hidrogênio aos alcinos também pode ser parcial (produzindo um haleto) ou total (formando um di-haleto), ocorrendo de acordo com a regra de Markovnikov.
ADIÇÃO EM AROMÁTICOS
As reações de adição em compostos aromáticos ocorrem em condições energéticas (altas pressão, catalisador ou aquecimento a altas temperaturas). As ligações duplas são quebradas, conforme representado a seguir:

REAÇÕES DE ELIMINAÇÃO
As reações orgânicas de eliminação ocorrem quando a partir de um único reagente orgânico formam-se dois produtos, um orgânico e um inorgânico. Podem ser:
- intramoleculares: a molécula perde um ou mais átomos para formar uma ligação dupla.

- intermoleculares: duas moléculas combinam-se, eliminando uma molécula menor. Esse tipo de reação é conhecida como condensação.

As reações de eliminação são inversas as de adição e, por isso, podem ser:
- Desidrogenação: eliminação de hidrogênios

- De-halogenação: eliminação de halogênios

- Desidro-halogenação: haletos de hidrogênio

- Desidratação: eliminação de água

REAÇÕES DE OXIDAÇÃO
Esse tipo de reação orgânica, assim como em reações inorgânicas, ocorre mediante a transferência de elétrons de uma espécie química para outra. Mas, em Química Orgânica, o termo oxidação é relacionado à remoção de hidrogênios e formação de uma ligação, que pode ser intramolecular ou entre um átomo da molécula e um átomo de oxigênio.
Essas reações ocorrem na presença de um agente oxidante, que se reduz (perde elétrons). Dessa forma, a substância orgânica recebe os elétrons do agente oxidante, se reduzindo. Os agentes oxidantes possuem átomos de oxigênio livres, representados por [O], quando em determinadas condições (presença de um ácido ou uma base forte, por exemplo). Esses átomos de oxigênio livres atuam promovendo a oxidação das moléculas orgânicas.
Um exemplo de reação de oxidação é a ozonólise. Considere a reação de oznólise do alceno a seguir:


TIPOS DE REAÇÕES NO ENEM
Reações orgânicas podem aparecer nas provas do Enem, cujos itens geralmente estão relacionados com processos industriais, solicitando . Considere o item a seguir:

Resolução: Alternativa A
A reação de ozonólise do alceno provoca quebra da ligação dupla ligação entre carbonos, produzindo um aldeído e uma cetona: benzaldeído e a propanona, respectivamente.