2° Lei da Termodinâmica: Entropia, ciclo de Carnot e máquinas térmicas
Publicado em: 07/07/2023Uma das primeiras coisas que o estudante precisa compreender é que as questões cobradas em sua prova do ENEM sobre a 2ª Lei da Termodinâmica sempre têm abordagem com aplicações no cotidiano, como o funcionamento de máquinas e refrigeradores. Para potencializar seu aprendizado vamos trabalhar diretamente com os conceitos aplicados a essas máquinas e refrigeradores.
Quando iniciamos os estudos deste assunto a primeira pergunta que podemos fazer é: O que é a 2ª Lei da Termodinâmica? Para começar a responder este questionamento, devemos entender que existe um sentido para transformações de energia em processos naturais, aquela velha ladainha de que o calor flui sempre de forma espontânea do corpo de maior temperatura para o de menor, para lembrar, basta revisar o conteúdo anterior da 1ª lei da Termodinâmica.
Desta forma, escolhemos então para consolidar o que é a 2ª Lei da Termodinâmica o enunciado de Kelvin-Planck que nos diz: “É impossível a construção de uma máquina que, operando em um ciclo termodinâmico, converta toda a quantidade de calor recebido em trabalho”.
Portanto, a 2ª Lei da Termodinâmica é todo processo que implica um rendimento inferior a 100% nas máquinas térmicas, ocorrendo sempre em um dado sentido e havendo sempre perda de calor.
Entropia
Após termos entendido o que é a 2ª Lei da Termodinâmica, antes de prosseguirmos, falaremos do conceito de entropia S, já que ela é uma grandeza termodinâmica associada a desordem de um sistema.
Obedecendo à conservação de energia total, a 1ª Lei da Termodinâmica informa que a energia não pode ser destruída, já a 2ª Lei da Termodinâmica relaciona as diversas transformações que esta energia pode sofrer com a variação de entropia ΔS e a quantidade de calor que o sistema troca em uma certa temperatura numa transformação reversível, temos:
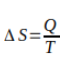
Onde o calor Q é medido em Joules [J], a temperatura T em Kelvin [K] e a variação de entropia ΔS é Joules por Kelvin [J/K].
Sendo proporcionais à variação de entropia e o calor, observamos que no universo a direção sempre será da ordem para a desordem, ou seja, da menor entropia para maior. Além disso, a variação de entropia de um sistema independe do caminho.
Máquinas Térmicas
Sabemos que uma máquina térmica é qualquer dispositivo capaz de converter energia térmica em trabalho mecânico, além de rejeitar algum calor. Temos as trocas de energia em uma máquina térmica sendo realizadas a seguir:
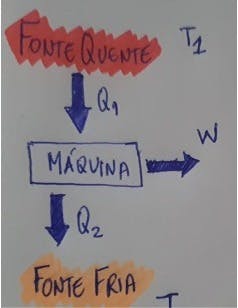
Temos, Q1 [calor da fonte quente] que será absorvido pela máquina, sendo que parte desse calor é transformado em W [Trabalho útil] e, outra parte, Q2 [calor da fonte fria] é despejado na fonte fria.

Ciclo de Carnot
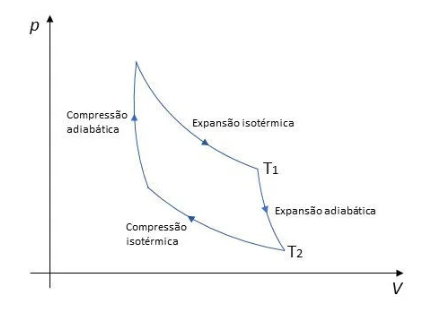
Em uma máquina térmica ideal o rendimento máximo, onde temos o calor transformado em trabalho, apresenta um ciclo termodinâmico chamado de ciclo de Carnot. Antes de entendermos este tipo de funcionamento apresentamos o conceito de transformações cíclicas, onde uma certa massa de gás irá realizar uma sequência de transformações gasosas, sempre retornando às condições iniciais de pressão, temperatura e volume, ou seja, o estado final sempre coincide com o estado inicial.
Com isso, o ciclo de Carnot sempre é reversível, sendo o funcionamento feito em quatro etapas: expansão isotérmica, expansão adiabática, compressão isotérmica e compressão adiabática.
Podemos calcular o rendimento da seguinte forma:
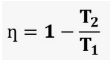
O gráfico é apresentado abaixo:
2ª Lei da Termodinâmica no Enem
Assim, podemos dizer que a 2ª Lei da Termodinâmica é um assunto indispensável no seu cronograma de preparação para sua prova do ENEM, mas, calma, o que foi apresentado é satisfatório e, além disso, serve sempre como material de revisão para seu ciclo de estudos. Veja agora um exemplo em uma questão do ENEM:
Até 1824 acreditava-se que as máquinas térmicas, cujos exemplos são as máquinas a vapor e os atuais motores a combustão, poderiam ter um funcionamento ideal. Sadi Carnot demonstrou a impossibilidade de uma máquina térmica, funcionando em ciclos entre duas fontes térmicas (uma quente e outra fria), obter 100% de rendimento.
Tal limitação ocorre porque essas máquinas
a. realizam trabalho mecânico.
b. produzem aumento da entropia.
c. utilizam transformações adiabáticas.
d. contrariam a lei da conservação de energia.
e. funcionam com temperatura igual à da fonte quente.
Como temos duas temperaturas fixas e o rendimento não poderá ser 100%, temos uma máquina térmica obedecendo à 2ª Lei da Termodinâmica, portanto a sempre teremos um aumento da entropia.
Esperamos que você tenha entendido os conceitos e continue focando nos seus estudos. Abraços!